目录
1 前言
超声具有安全、快捷的特点,是使用最广泛的医学影像筛查和诊断的设备。但传统超声成像质量受到组织内部散射及声学衍射的影响,分辨率受限于半个波长[1],大大限制了其在深部组织成像与研究中的应用。超声超分辨成像技术能够突破声学衍射极限,将空间分辨率提升10倍,提供有关毛细血管及微观组织结构的丰富结构及功能信息,对于脑科学研究、血管疾病无创诊断及治疗评估等具有重大意义[2],是超声成像前进的必然,也定能彻底颠覆超声成像在人们心中速度快,但是清晰度低、分辨率差的旧观念。
组织和血管结构的超分辨成像技术受到光学显微镜新进展的启发。光学超分辨方法,如光激活定位显微技术(Photoactivated localization microscopy, PALM)、随机光学重构显微技术(Stochastic optical reconstruction microscopy, STORM)、超分辨光学波动成像(Super-resolution optical fluctuation imaging,SOFI)、结构照明显微技术(Structured illumination microscopy, SIM)能够突破光学衍射极限,实现高分辨率荧光显微成像,并进一步启发了基于超声造影剂及结构声场的组织和血管结构超分辨成像技术[3-6]。
2 血管结构超分辨成像技术
血管结构超分辨成像主要分为基于微泡的血管结构超分辨成像技术以及基于相变液滴的血管结构超分辨成像技术。
2.1 血管结构超分辨成像技术
2006年提出的光激活定位显微技术和随机光学重构显微技术,通过反复激活-猝灭荧光分子,将传统光学显微镜的分辨率提高了十倍以上[3,4]。受到PALM的启发,2010年,Couture等提出了FPALM光学超分辨技术的超声应用——超声微泡超分辨定位成像技术(Microbubble ultrasound super-localization imaging,MUSLI),超声微泡造影剂对应荧光标记,超快可编程超声扫描仪对应照相机。区别于传统超声造影技术的是,MUSLI结合超快速成像(10000帧/秒)和微泡破坏平面波序列设计实现了微泡在空间上的稀疏分布,避免了不同微泡之间的干扰,进而可以实现了微米级精度的单微泡定位[7]。
2011年,Siepmann等通过对稀疏分布的微泡造影剂进行质心检测实现了小鼠体内肿瘤血管结构的超分辨成像,相较传统最大强度投影图像显著提高了成像分辨率,为肿瘤血管定量提供了有力的成像工具[8]。2013年,Viessman等将稀释的微泡造影剂悬浮液注入深度为4cm的狭窄的体膜管道内,通过对多个空间孤立的微泡进行空间检测、质心定位、定位事件累积构建超分辨微泡定位密度图,显著区分了两个距离不到超声波波长一半的结构[9]。2015年,Christensen-Jeffries等基于鼠耳超声造影图像,在Viessman超分辨成像方法的基础上,结合最大互相关法实现了0.6cm-1.5cm深度范围内血管结构、血流流向及血流速度的区分,如图1所示,提供了一种无创观测血管结构及血流功能的超分辨成像技术[10]。
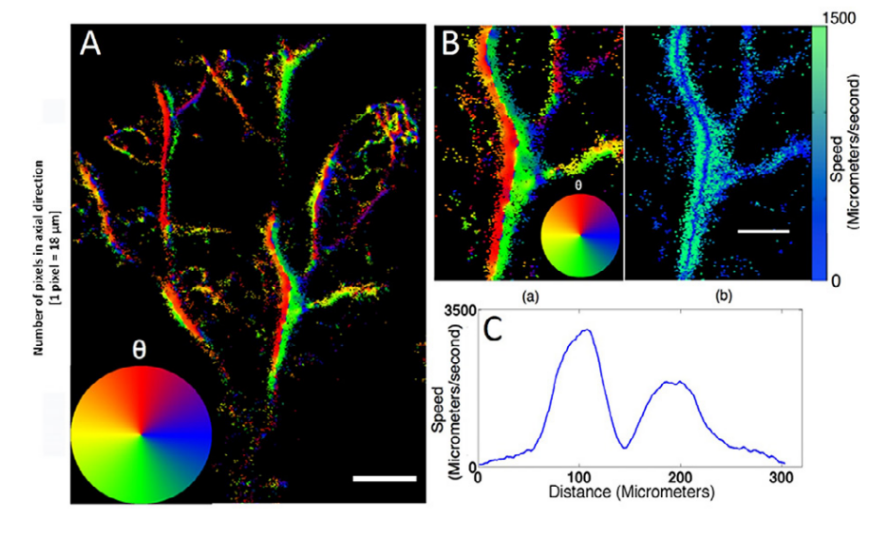
图 1 (A)鼠耳超分辨率方向图,色轮指示血流方向,比例尺为1mm;(B)A图局部超分辨率方向图及相应的流速图;(C)400mm截面上的平均流量曲线 [10]。
基于稀疏微泡定位思路,Desailly和O‘Reilly于2013年同时提出了两种3D超分辨率方法,Desailly采用1.5D的超声探头实现了微流道的三维超分辨重建[11],O‘Reilly采用半球形超声阵列探头实现了穿人颅骨的三维管道结构重建,如图2所示,从而为实现三维全方位的血管结构超分辨成像奠定了基础[12]。
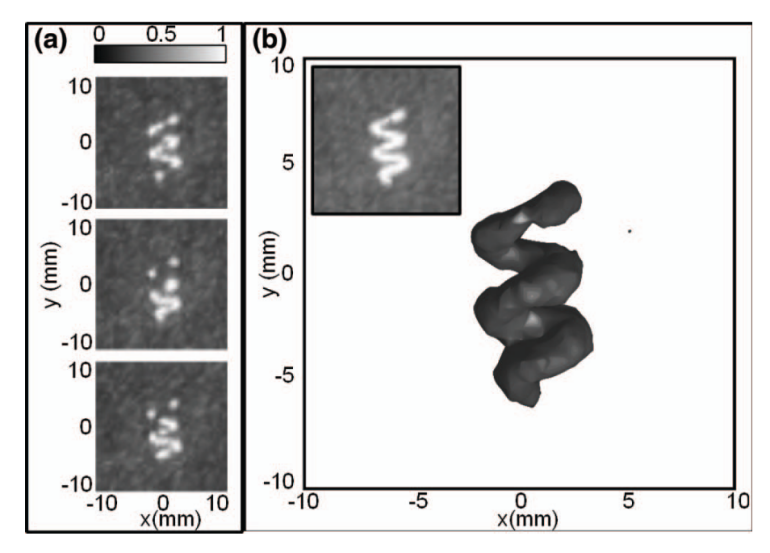
图 2 (a)管道体膜三次不同扫描采集的归一化像素强度的z投影图像;(b)管道体膜3D渲染图。插入图为相同体积的灰度均值z投影图像[12]。
基于以上研究,Errico等于2015年提出的超声定位显微镜(Ultrasound Localization Microscopy,ULM)以500帧/秒的帧率进行超快速平面波成像,通过定位单个注入的微气泡并以亚波长分辨率跟踪其位移,在150s内实现了小鼠全脑血管超分辨结构图和速度图重建,如图3所示,成为超声超分辨成像的代表性工作[13]。
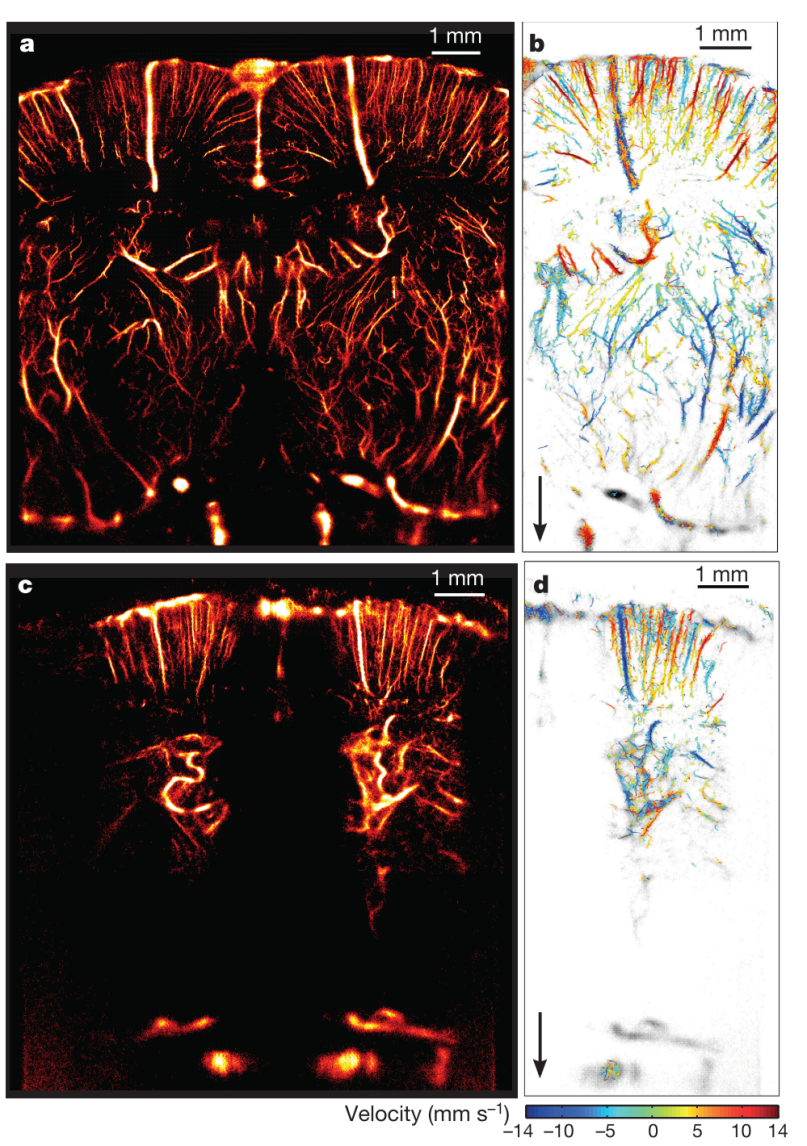
图 3 基于打薄的颅骨和完整的颅骨的大鼠大脑ULM超分辨成像。(a)基于打薄头骨的ULM超分辨成像;(b)a图中部分血管的平面流速图;(c)基于完整颅骨的ULM超分辨成像,骨骼存在造成超声波的衰减,分辨率降低;(d)c图中部分血管的平面速度图[13]。
以上策略基于稀疏单微泡的中心定位,通过定位事件的逐帧累积实现超分辨结构重建,为了保证重建结构的完整性,需要有足够的定位事件累积,但为了保证定位精度,每帧超声图像中微泡的空间分布必须足够稀疏,从而极大限制了超分辨重建时间分辨率的提高。光学超分辨方法SOFI利用荧光信号的灰度涨落特性,以非定位的方式极大提升了超分辨重建的速度[5]。受到SOFI的启发,Bar-Zion将微泡沿着血流运动产生的像素级灰度波动类比为荧光闪烁引起的灰度波动,通过单像素级灰度涨落信号的自相关性分析,将时间分辨率提升至数百毫秒[14]。在此基础上,Bar-Zion进一步结合血管结构的空间的稀疏性提出了基于稀疏性的超声超分辨率血流动力学成像技术(Sparsity-based Ultrasound Super- resolution Hemodynamic Imaging,SUSHI),达到了25Hz的时间分辨率[15]。受到光学超分辨方法——超分辨径向涨落技术(Super-resolution Radial Fluctuation,SRRF)的启发[16],Zhang于2020年提出的超声衍射衰减显微镜(ultrasound diffraction attenuation microscopy,UDAM)结合了微泡的时间尺度涨落特性和空间尺度梯度收敛特性,利用临床低帧率(30Hz)探头150s内采集的造影数据,实现了基于高浓度微泡的高时间分辨率超分辨成像[17]。
利用深度学习模型和血管结构稀疏先验,可以在微泡分布亚稀疏的条件下实现超分辨成像,从而减少超分辨成像的时间。Van Sloun等人于2018年提出了一种利用深度学习的网络Deep-ULM来实现超分辨成像的方法。Deep-ULM使用深度卷积神经网络拟合低分辨率原始图像和超分辨图像之间的映射关系,能够在高浓度造影剂分布下实现超分辨,且在GPU配置下,每秒可生成1250个128*128大小的高分辨率图像块,但网络训练耗时较长,大约需要100min以上[18]。为了提高模型训练速度,Liu于2020年提出了改进的亚像素卷积神经网络(modified sub-pixel convolutional neural network-ultrasound localization microscopy,mSPCN-ULM),在插值神经网络的基础上引入加速训练过程的残差块,在45min内即可实现深度学习模型的收敛[19]。
2.2 基于相变液滴的血管结构超分辨成像技术
基于定位的光学超分辨成像方法与基于微泡的超声超分辨成像方法之间的根本区别在于:微泡并不会像荧光一样,有“打开”和“关闭”两种状态。在PALM中,一部分荧光分子可以被随机地打开和关闭,从而产生“闪烁”的荧光信号,而微泡在超声探头下已经处于“开启”状态。
因此,为了保证微泡定位的准确性,必须确保微泡的空间分布是稀疏的,并且微泡需要随着时间产生位置的变换,即处于流动状态,以便在空间和时间上积累不同的定位事件,该方法的局限性在于它们会严重取决于血液流动的速度和注入微泡的浓度,缓慢的微血流速度和难以控制的体内微泡浓度是限制基于微泡定位的超分辨速度的重要因素[1]。
由全氟化碳制成的相变液滴可以在超声波或光的激发下,从液相转变为气相(即蒸发成气泡),呈现类似于荧光的闪烁特性,因此可以利用超声波或光信号,在空间和时间上选择性地激活纳米液滴,以按需提供超声对比信号;其次,纳米液滴的纳米尺寸可能允许例如渗入癌组织,从而增强组织的超声信号对比度。
基于光激活纳米液滴(laser-activated nanodroplets ,LANDs),Luke等人通过对LAND反复施加光学刺激,提供数百至数百毫秒的高超声对比度,如图4所示,通过捕获闪烁LAND的高帧频超声图像及邻帧差分实现闪烁LAND的提取,基于定位累积实现超分辨,并尝试在体内进行了LAND激活定位超分辨成像[20]。
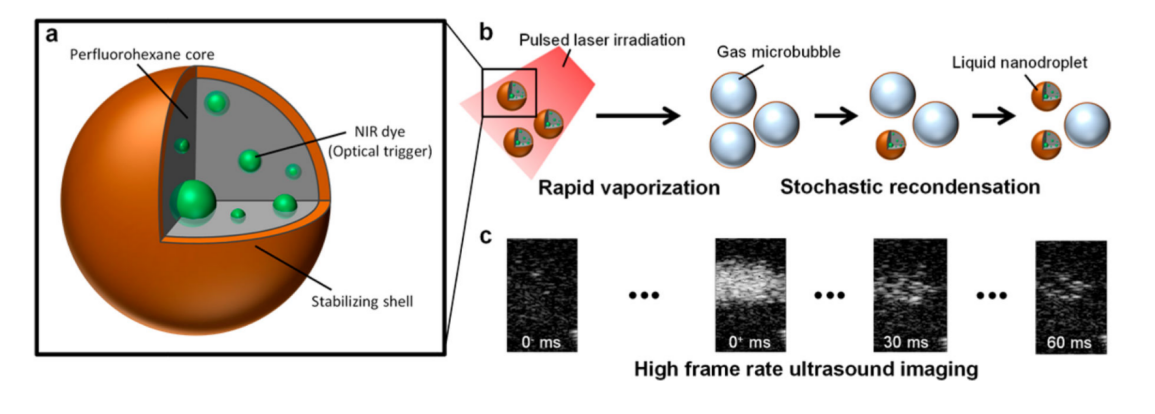 图 4 (a)LAND组成结构示意图;(b)LAND通过脉冲激光照射蒸发(左)。 在其瞬态微泡状态下,声波被反射,从而提供超声对比。 汽化后,LAND随机冷凝,不再提供超声对比;(c)激光脉冲激发之后30毫秒和激光脉冲之后60毫秒(从左到右)的超声图像证明了LANDs的闪烁[20]。
图 4 (a)LAND组成结构示意图;(b)LAND通过脉冲激光照射蒸发(左)。 在其瞬态微泡状态下,声波被反射,从而提供超声对比。 汽化后,LAND随机冷凝,不再提供超声对比;(c)激光脉冲激发之后30毫秒和激光脉冲之后60毫秒(从左到右)的超声图像证明了LANDs的闪烁[20]。
基于声激活的十氟丁烷纳米液滴,Zhang等人于2018年提出了声学稀疏激活定位显微镜技术(Acoustic wave sparsely activated localization microscopy,AWSALM),由于液滴需要的激活能量较高,AWSALM采用扫描的聚焦波束设计来确保液滴的可靠激活,如图5所示,但限制了成像速度的提升[21],为了提高液滴的激活效率,Zhang于2019年利用平面波激活低沸点八氟丙烷纳米液滴成像,可以在200 ms内分辨出190 µm的亚波长微管道结构,在慢速流动条件下,其超分辨重建速度较AWSALM提升了约两个数量级[22]。
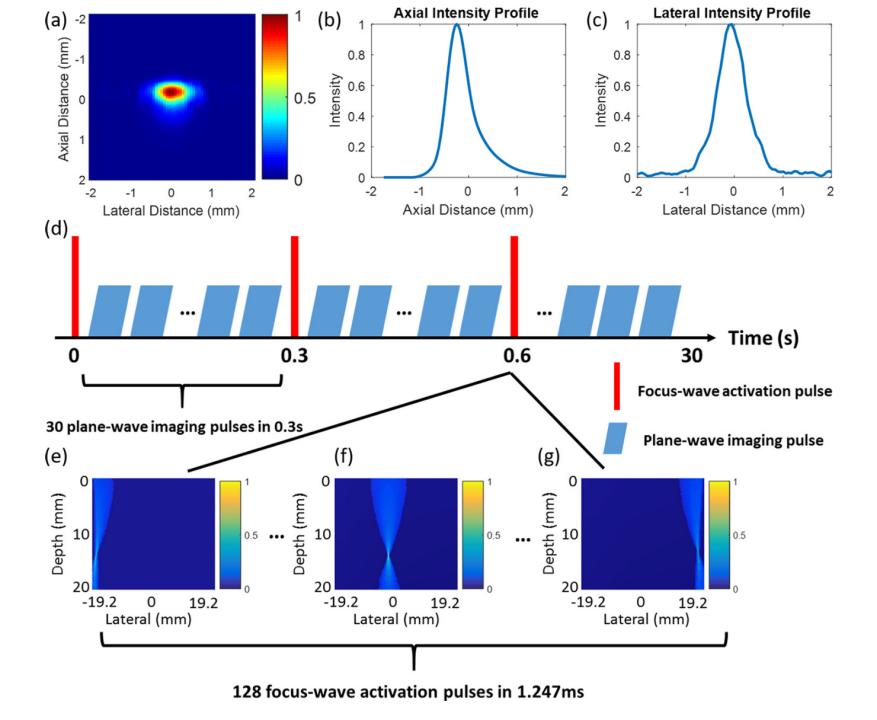
图 5(a)–(c)超声成像系统的分辨率定量(a)对2厘米深处直径为50 μm的管道进行超声成像,测量轴向(b)和横向(c)的半高全宽;(d)“激活成像”超声脉冲序列图示;(e)-(g)显示了在整个聚焦区域进行扫描时三个不同的激活聚焦脉冲声束的强度分布[21]。
基于纳米液滴的超分辨成像的优势在于:液滴具有声学可调控性,能够以超声脉冲重复频率被激活和去激活,从而可以借助频率调控提高定位事件累积效率,提高时间分辨率,并且可以使用更高浓度的液滴预填充血管(因为在激活之前,超声无法看到液滴),通过打开或关闭液滴以快速积累定位,但目前Zhang使用的声学激活的纳米液滴在激活后大概率会被汽化,同一液滴无法被反复激活,从而阻碍时间分辨率的进一步提升。
3 组织超分辨成像技术
受到SIM光学超分辨成像技术的启发,Ilovitsh于2018年提出了声学结构照明超分辨重建技术(acoustical structured illumination,ASI),成像流程如图6所示,利用多点聚焦波束设计实现结构声场激发,将组织成像分辨率提升了两倍,其优势在于,不需要借助超声造影剂即可提高器官组织的分辨率,但受到多点聚焦的能量及衍射的限制,其分辨率最高只可提高两倍[23]。
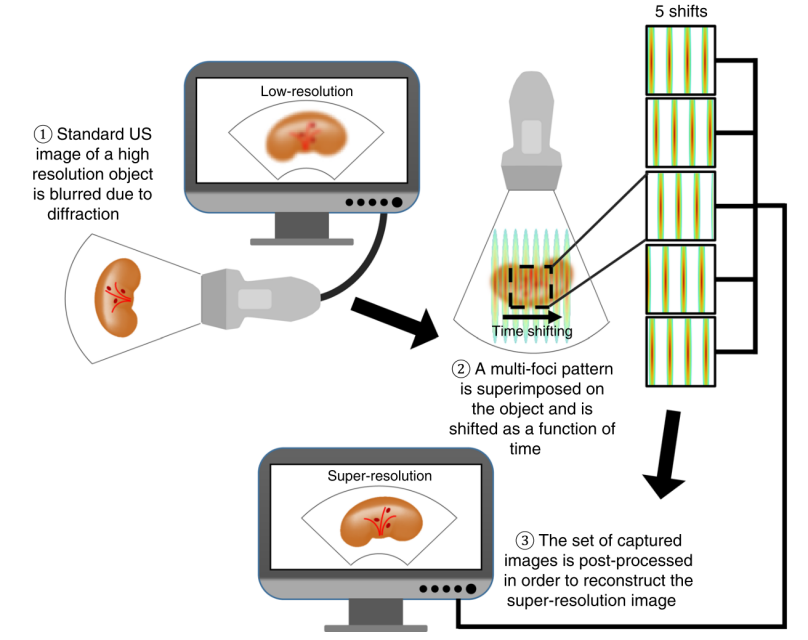
图 6 ASI成像流程示意图[23]
4 应用领域
在疾病诊断及治疗评估方面,超分辨成像可以突破衍射极限的限制,提供丰富的微结构信息,从而使该技术成为临床诊断和治疗的潜在强大工具,目前在疾病诊断及治疗评估上的应用集中于血管化疾病,现有研究涉及肿瘤组织的血管形态分析[24]、淋巴系统血流流速流向分析[25]、乳腺癌的化疗监测的临床初步实验等[26-28],临床应用研究处于初探阶段。在脑科学研究方面,基于人离体头骨的超声超分辨成像可达<50 μm的空间分辨率[12,23],基于削薄的小鼠颅骨和15 MHz高频探头可将空间分辨率提升至10 μm [13],成像深度可达12.5 mm[13]。
4.1 疾病诊断及治疗评估
超分辨成像可以突破衍射极限的限制,提供丰富的微结构信息,从而使该技术成为临床诊断和治疗的潜在强大工具,目前在疾病诊断及治疗评估上的应用集中于血管化疾病,如恶性肿瘤、糖尿病等。
Lin等于2017年应用ULM来观察大鼠纤维肉瘤中的3-D微血管形态特征,并将微血管特征与健康对照组进行比较,超分辨率成像结果显示肿瘤表现出异于正常组织的血管特征,例如高度曲折[24],其主要挑战在于,基于3D体积成像来分析高度血管化的病变组织才最有效的,并且不够精确的运动校正很容易造成数十微米的成像误差和伪影。淋巴系统在肿瘤学中起着至关重要的作用。在患有癌症的患者中,肿瘤细胞经常通过淋巴通道运输到区域淋巴结进而到达全身组织。Zhu等人于2019年对兔淋巴结进行了3D超分辨成像并进行了流速流向分析,为临床淋巴系统病变诊断提供了有力的工具[25]。
对肿瘤脉管系统进行超分辨成像的一个特殊挑战是血管形态的复杂性,肿瘤血管有着异于正常血管的高弯曲度血管结构及密集的血管分布,组织性较低,且临床成像中的成像切片厚度更高、帧率更低,这使得微泡运动轨迹的关联更加模糊,为功能分析带来困难,为了解决这个问题,利用卡尔曼滤波器和线性运动模型的跟踪算法,Opacic于2018年在ULM的基础上,对三种不同类型的肿瘤进行了血管结构超分辨成像及轨迹分析,并建立了一系列基于血管形态学的定量参数,此外,该方法的临床可行性被证明可用于乳腺癌的化疗监测 [26-28],如图7所示,肿瘤超分辨图像具有清晰的血管分布特征,包括高度血管化的边缘及轮辐状延伸结构。

图 7 (a)乳腺癌患者的B模式图像,病灶区域边缘不清晰;(b)微泡注射后的最大强度投影图像证实了肿瘤的高度血管化特征,微血管结构模糊;(c-e)肿瘤超分辨图,分别显示了微泡轨迹分布、血流方向分布和速度分布[28]。
但将研究结果应用于实际临床的挑战在于:首先,不同的人体器官具有不同的功能和解剖血管特性,需要考虑这些特性的基础上控制微泡分布的浓度,其次,临床超声扫描仪需要使用较低的频率以充分穿透组织且体素尺寸较大,为微泡的精确定位和追踪带来困难[1]。
总之,基于ULM的肿瘤超分辨成像在临床应用中的可行性得到了证明,一些超声波设备供应商考虑在其超声扫描的软件中嵌入此类分析方法。
4.2 脑科学研究
对脑部微小血管进行超分辨成像对神经病学的诊断和治疗都具有很大的意义。微血管的异常被认为是中风和阿尔茨海默病等疾病的病因。然而,颅骨会造成超声波的高度衰减并引起成像畸变,因此,超声成像和治疗必须基于可以更好穿透骨骼的低频超声波或声学窗口(例如颞下枕和下枕窗口)进行。
O'Reilly于2013年使用半球阵列设计用于经颅超声成像,通过离体人类头骨对管体模中的单个气泡进行成像,通过高斯拟合进行超分辨成像,这项概念验证研究表明,可以通过完整的颅骨进行超分辨成像,空间分辨率可以达到50 μm[12]。
Errico等人于2015年通过开颅窗和削薄的小鼠颅骨,借助超快速平面波对全脑进行了血管结构超分辨成像,但其使用探头中心频率高达15 MHz,不能以穿透人的头骨,但有望应用于术中或早产儿的人脑成像。Errico进一步指出,从理论上讲,将其成像频率降低至2.5 MHz仍可产生6毫米的各向同性分辨率,从而有望探索ULM在人脑血流超分辨成像上的可行性[13]。
实际上,Lindsey等人于2011年已经使用多矩阵阵列、以常规分辨率获得了人脑威力世环的3-D图像[29,30]。此外,Soulioti等于2020年使用2.5 MHz诊断探头透过人颞骨进行了管体模的经颅超分辨率成像,其精度达到了O'Reilly在2013年发表工作的水平,进一步验证了此方法的可行性[31]。
5 超分辨成像技术面临的挑战
(一)临床条件下的高精度超分辨成像
以血管结构超分辨成像为例,临床超声造影使用的造影剂浓度往往较高,且目标成像区域深,由于临床设备的限制及采集深度的影响,采集到的超声图像信噪比且帧率较低,从而给超分辨成像带来极大的挑战,此外,应用于临床的超分辨成像结果需要足够准确,从而更好地辅助医生进行诊断和评估。因此,开发适应于临床条件(高浓度造影剂、低信噪比)的高精度超分辨成像技术十分关键[32]。
(二) 实时3D超分辨成像
实时3D超分辨成像使得医生可以依据更高分辨率的动态数据进行诊断和评估,但现有的超声超分辨成像技术无法发挥超声实时性的优势,尤其是在临床采集条件下,以肾为例,临床常用憋气的方法来定量测量超声造影灌注,但正常人憋气时长大约在10s-30s时间,远远不能满足超分辨的时间要求;其次, 3D超分辨成像对于全面、精确的高分辨率血管及组织观察是十分必要的,但目前3D超分辨成像成果不及基于2D超声成像数据的超分辨成像成果,一方面是硬件设备及重建速度带来的限制,另一方面是现有的超分辨成像方法本身时间分辨率亟待提高,因此如何在短时间内实现3D超分辨成像是一个亟待解决的问题。
(三) 无造影剂下的超分辨成像
目前,组织超分辨成像技术方面的研究匮乏,基于超声造影剂的血管结构超分辨成像研究较多,但目前广泛使用的微泡造影剂仅局限于血液循环,难以进入到组织内部[2],另一方面,造影剂的使用带来了血流流速、造影剂浓度的诸多限制[1],因此如何在无造影剂的条件下实现组织及血管结构的超分辨成像对于提高超分辨成像速度、扩展成像类型是具有很大意义的。
(四) 高精度的3D配准方法
器官运动是超分辨成像的另一挑战。 据测量,由于心动周期而导致的人脑运动高达0.5毫米,导致回声位置发生其他低频偏移,因此,高精度的运动校正算法对于超分辨成像而言是十分必要的[1]。
6 超声超分辨成像技术发展建议
6.1 大力发展3D/4D实时超分辨成像技术
3D实时超分辨成像技术能够提供全方位、动态的血管及组织超分辨图像,对于科学研究和临床成像应用具有巨大的意义,但三个关键问题阻碍了3D实时超分辨的广泛应用:
(1)超声探头采集方式、图像重建速度和重建质量的限制。目前的临床3D成像。
(2)研究以2D切片扫描和机械步进的方式进行3D图像重建,成像效率低下且扫描轴向的分辨率远低于成像平面的分辨率;受到探头灵敏度和采集通道的限制,基于矩阵探头的3D成像质量和成像速度不尽如人意,难以实现高质量的超分辨成像。
(3)超分辨成像算法的局限性。目前的3D超分辨成像技术均以稀疏微泡定位为基础,存在时间分辨率和定位精度之间的矛盾。
(4)可调控造影剂的匮乏。由全氟化碳制成的相变液滴可以在超声激发下从液相转变为气相,因此可以利用超声波或光信号选择性地激活纳米液滴,以按需提供超声对比信号,但目前纳米液滴在激活可控性较差。
针对以上三个问题,对应建议如下:
(1)基于新型声控的纳米液滴,结合声场设计及脉冲频率调控,在超声精准定点激活后产生超声对比信号,实现无创无辐射下的定点可控3D/4D超声超分辨成像。
(2)引入高灵敏度矩阵探头,发展新型三维重建算法和通道设计方案,提高数据采集及重建速度。
(3)开发基于高密度造影剂分布下的3D超分辨成像方法,提高每帧的定位效率,从而有效缩短超分辨成像的时间。
6.2 大力推进超分辨成像技术的临床应用
相较传统超声成像技术,超分辨成像技术可以将空间分辨率提升10倍,从而实现亚波长结构的区分和检测,提供有关毛细血管及微观组织结构的丰富信息,对于肿瘤、糖尿病、动脉硬化等血管疾病的无创诊断和治疗评估具有重大意义。
在临床应用方面,目前仍存在以下挑战:
(1)临床采集条件的限制。临床超声造影存在造影剂较高、成像区域深、采集设备受限等问题,导致采集到的超声图像信噪比、帧率低,难以实现实时超分辨成像。
(2)运动偏移的影响。在临床应用中,心动周期会造成采集图像间的位置偏移,从而极大干扰超分辨成像的质量和精度。
(3)临床研究的匮乏。临床研究处于初步阶段,缺乏系统、规范的超分辨成像疾病诊疗体系。
针对以上问题,对应建议如下:
(1)探索有效的高精度动态配准策略,大幅度提升配准的效能。
(2)开发适应于临床条件(高浓度造影剂、低信噪比)的高精度、高时间分辨率超分辨成像技术。
(3)探索定量参数和疾病发生发展之间的关系,从而建立一套基于超分辨成像的疾病诊疗体系。
(4)结合实时超分辨成像技术,开发实时成像可视化下的手术介导和监测产品,挖掘超分辨实时成像技术“早发现”的诊断优势和“早治疗”的治疗评估优势,实现临床诊治策略的全面革新和临床精确诊疗水平的极大提升。
6.3 发展超声超分辨智能成像新技术
微观组织的结构信息对于疾病的机理研究、治疗评估及指导具有十分重要的意义,传统超声技术由于衍射极限的限制,无法观测微观组织结构,而组织超声超分辨成像技术可以打破衍射极限的限制,使得微观组织结构的实时高分辨率、高精度成像成为可能。
但目前组织超分辨成像技术仍存在以下挑战:
(1)分辨率的限制。基于结构声场设计的组织超分辨成像技术受到多点聚焦的能量及衍射的限制,其分辨率最高只可提高两倍[23]。
(2)运动偏移的干扰。在实际采集中,心动周期、呼吸周期及组织自身微小蠕动引入的复杂组织运动会导致图像偏移,从而极大影响微观结构超分辨成像的质量和精度。
经过60多年的发展,人工智能在算法、算力(计算能力)和算料(数据)等“三算”方面取得了重要突破,基于人工智能的智能成像技术给予了超声超分辨成像技术巨大的发展空间,为构建智能化超分辨成像体系提供了新思路,对此建议如下:
(1)将人工智能和成像设备融合,进行软硬结合的设备研究,推出全新超声超分辨智能成像技术方案,实现超高分辨率的成像处理及图像分析。
(2)运用人工智能技术实现高精度运动配准,解决复杂的多尺度运动配准问题。推动深度学习技术与组织成像技术的深度融合,利用深度学习网络促进组织超分辨成像分辨率、成像速度和成像精度的提升。
参考文献
[1] Christensen-Jeffries, K., Couture, O., Dayton, P. A., Eldar, Y. C., Hynynen, K., Kiessling, F. (2020). Super-resolution Ultrasound Imaging. Ultrasound in Medicine & Biology, 46(4), 865–891.
[2] Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., & Tanter, M. (2018). Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 65(8), 1304–1320.
[3] Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., … Hess, H. F. (2006). Imaging intracellular fluorescent proteins at nanometer resolution. Science, 313(5793), 1642–1645.
[4] Rust M J, Bates M, Zhuang X. (2006). Stochastic optical reconstruction microscopy (STORM) provides sub-diffraction-limit image resolution. Nature Methods, 3(10), 793–795.
[5] Dertinger, T., Colyer, R., Iyer, G., Weiss, S., & Enderlein, J. (2009). Fast, Background-free, 3D super-resolution optical fluctuation imaging (SOFI). 106(52),22287-22292.
[6] Lal, A., Shan, C., & Xi, P. (2016). Structured illumination microscopy image reconstruction algorithm. IEEE Journal on Selected Topics in Quantum Electronics, 22(4), 1–15.
[7] Couture, O., Besson, B., Montaldo, G., Fink, M., & Tanter, M. (2011). Microbubble ultrasound super-localization imaging (MUSLI). IEEE International Ultrasonics Symposium, IUS, 1285–1287.
[8] Siepmann, M., Schmitz, G., Bzyl, J., Palmowski, M., & Kiessling, F. (2011). Imaging tumor vascularity by tracing single microbubbles. IEEE International Ultrasonics Symposium, IUS, 1906–1908.
[9] Viessmann, O. M., Eckersley, R. J., Christensen-Jeffries, K., Tang, M. X., & Dunsby, C. (2013). Acoustic super-resolution with ultrasound and microbubbles. Physics in Medicine and Biology, 58(18), 6447–6458.
[10] Christensen-Jeffries, K., Browning, R. J., Tang, M. X., Dunsby, C., & Eckersley, R. J. (2015). In vivo acoustic super-resolution and super-resolved velocity mapping using microbubbles. IEEE Transactions on Medical Imaging, 34(2), 433–440.
[11] Desailly, Y., Couture, O., Fink, M., & Tanter, M. (2013). Sono-activated ultrasound localization microscopy. Applied Physics Letters, 103(7) ,174107.
[12] O’Reilly, M. A., & Hynynen, K. (2013). A super-resolution ultrasound method for brain vascular mapping. Medical Physics, 40(11), 1–7.
[13] Errico, C., Pierre, J., Pezet, S., Desailly, Y., Lenkei, Z., Couture, O., & Tanter, M. (2015). Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature, 527(7579), 499–502.
[14] Bar-Zion, A., Tremblay-Darveau, C., Solomon, O., Adam, D., & Eldar, Y. C. (2017). Fast Vascular Ultrasound Imaging with Enhanced Spatial Resolution and Background Rejection. IEEE Transactions on Medical Imaging, 36(1), 169–180.
[15] Bar-Zion, A., Solomon, O., Tremblay-Darveau, C., Adam, D., & Eldar, Y. C. (2018). Sushi: Sparsity-based ultrasound super-resolution hemodynamic imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 65(12), 2365–2380.
[16] Gustafsson, N., Culley, S., Ashdown, G., Owen, D. M., Pereira, P. M., & Henriques, R. (2016). Fast live-cell conventional fluorophore nanoscopy with ImageJ through super-resolution radial fluctuations. Nature Communications, 7(1), 1–9.
[17] Zhang, J., Li, N., Dong, F., Liang, S., Wang, D., An, J. (2020). Ultrasound Microvascular Imaging Based on Super‐Resolution Radial Fluctuations. Journal of Ultrasound in Medicine.
[18] van Sloun, R. J., Solomon, O., Bruce, M., Khaing, Z. Z., Wijkstra, H., Eldar, Y. C., & Mischi, M. (2018). Super-resolution ultrasound localization microscopy through deep learning. arXiv preprint arXiv:1804.07661.
[19] Liu, X., Zhou, T., Lu, M., Yang, Y., He, Q., & Luo, J. (2020). Deep Learning for Ultrasound Localization Microscopy. IEEE Transactions on Medical Imaging.
[20] Luke, G. P., Hannah, A. S., & Emelianov, S. Y. (2016). Super-Resolution Ultrasound Imaging in Vivo with Transient Laser-Activated Nanodroplets. Nano Letters, 16(4), 2556–2559.
[21] Zhang, G., Harput, S., Lin, S., Christensen-Jeffries, K., Leow, C. H., Brown, J., … Tang, M. X. (2018). Acoustic wave sparsely activated localization microscopy (AWSALM): Super-resolution ultrasound imaging using acoustic activation and deactivation of nanodroplets. Applied Physics Letters, 113(1),014104.
[22] Zhang, G., Harput, S., Hu, H., Christensen-Jeffries, K., Zhu, J., Brown, J., … Tang, M. X. (2019). Fast acoustic wave sparsely activated localization microscopy: Ultrasound super-resolution using plane-wave activation of nanodroplets. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 66(6), 1039–1046.
[23] Ilovitsh, T., Ilovitsh, A., Foiret, J., Fite, B. Z., & Ferrara, K. W. (2018). Acoustical structured illumination for super-resolution ultrasound imaging. Communications Biology, 1(1),1-11.
[24] Lin, F., Shelton, S. E., Espíndola, D., Rojas, J. D., Pinton, G., & Dayton, P. A. (2017). 3-D ultrasound localization microscopy for identifying microvascular morphology features of tumor angiogenesis at a resolution beyond the diffraction limit of conventional ultrasound. Theranostics, 7(1), 196–204.
[25] Zhu, J., Rowland, E. M., Harput, S., Riemer, K., Leow, C. H., Clark, B., ... & Brown, J. (2019). 3D super-resolution US imaging of rabbit lymph node vasculature in vivo by using microbubbles. Radiology, 291(3), 642-650.
[26] Opacic, T., Dencks, S., Theek, B., Piepenbrock, M., Ackermann, D., Rix, A., … Kiessling, F. (2018). Motion model ultrasound localization microscopy for preclinical and clinical multiparametric tumor characterization. Nature Communications, 9(1), 1–13.
[27] Dencks, S., Piepenbrock, M., Schmitz, G., Opacic, T., & Kiessling, F. (2017). Determination of adequate measurement times for super-resolution characterization of tumor vascularization. IEEE International Ultrasonics Symposium, IUS, 1906–1908.
[28] Dencks, S., Piepenbrock, M., Opacic, T., Krauspe, B., Stickeler, E., Kiessling, F., & Schmitz, G. (2018). Clinical pilot application of super-resolution US imaging in breast cancer. IEEE transactions on ultrasonics, ferroelectrics, and frequency control, 66(3), 517-526.
[29] Lindsey, B. D., Light, E. D., Nicoletto, H. A., Bennett, E. R., Laskowitz, D. T., & Smith, S. W. (2011). The ultrasound brain helmet: new transducers and volume registration for in vivo simultaneous multi-transducer 3-D transcranial imaging. IEEE transactions on ultrasonics, ferroelectrics, and frequency control, 58(6), 1189-1202.
[30] Lindsey, B. D., Nicoletto, H. A., Bennett, E. R., Laskowitz, D. T., & Smith, S. W. (2014). 3-D transcranial ultrasound imaging with bilateral phase aberration correction of multiple isoplanatic patches: A pilot human study with microbubble contrast enhancement. Ultrasound in Medicine & Biology, 40(1), 90-101.
[31] Soulioti, D. E., Espíndola, D., Dayton, P. A., & Pinton, G. F. (2019). Super-resolution imaging through the human skull. IEEE transactions on ultrasonics, ferroelectrics, and frequency control, 67(1), 25-36.
[32] Song, P., Trzasko, J. D., Manduca, A., Huang, R., Kadirvel, R., Kallmes, D. F., & Chen, S. (2017). Robust ultrasound super-resolution microvessel imaging with spatiotemporal nonlocal means filtering and bipartite graph-based microbubble tracking. IEEE International Ultrasonics Symposium, IUS,149–167.





