背景
单分子定位显微(SMLM)成像,包括光激活定位显微(PALM)和随机光学重构显微(STORM)。两者的原理相似,成像过程均需要往复循环,在每个循环周期里,荧光分子团被连续的激活、成像及漂白。2006年9月,Eric Betzig,Harald F.Hess等人首次在Science上提出光激活定位显微技术photoactivated localization microscopy(PALM)[1]。2006年底,美国霍华德休斯医学研究所的庄小威组开发出来一种类似于PALM的方法,将该过程命名为随机光学重构显微技术stochastic optical reconstruction Microscopy (STORM),并将其用于研究细胞内源蛋白的超光学衍射极限分辨率定位[2-3]。
工作原理
光激活定位显微技术photoactivated localization microscopy(PALM)其基本原理是首先使用光活化绿色荧光蛋白(PA-GFP)来标记蛋白质[4],并将较低光功率的405nm 激光照射细胞表面,用于激活稀疏分布的几个荧光分子。之后用561nm激光照射,使已经激活的荧光分子因为受激发射而产生荧光信号,接着继续照射使这些发光的荧光分子产生漂白, 在下一轮不能被激发光再次激活。之后交替使用405nm和561nm激光来进行激活,激发和漂白其他的荧光分子。往复循环,直至全部完成稀疏标记的细胞成像。图1展示了使用光激活定位显微技术PALM 定位单个荧光分子最后实现超光学衍射极限分辨率成像的示意图。PALM的成像方法只能观察基于细胞外源表达的蛋白质。
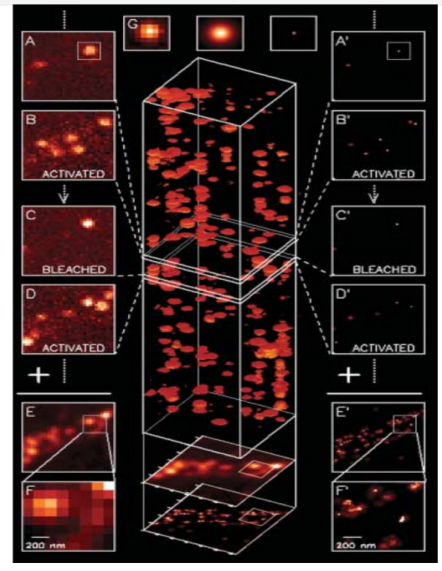
图 1 应用PALM 技术定位单个荧光分子最后实现超分辨率成像的示意图[1]
STORM技术中,使用Cy3和Cy5分子对作为荧光标记实现超分辨成像,因为不同波长光可以控制Cy5在荧光激发态和暗态之间切换,例如红色633nm激光可以激活Cy5发射荧光,同时长时间照射可以将Cy5分子转换成暗态不发光。之后用绿色的532nm激光照射Cy5分子时,可以将其从暗态转换成荧光态,而此过程的长短依赖于第二个荧光分子Cy3和Cy5之间的距离,因此,当Cy3和Cy5交联成分子对时,具备了特定的激发光转换荧光分子发射波长的特性。在显微观察前,首先将待测观察样品用染剂染色,将Cy3和Cy5分子对胶联到特异的蛋白质抗体上,就可以用抗体来标记细胞的内源蛋白,然后用波长为633nm的红光长时间照射样品使Cy5发射荧光后全部转化为暗态,采用波长为532nm的绿光激发Cy3,从而使Cy5处于荧光态。激发过程中应使强度足够低,以保证在衍射极限范围内至多只有一个Cy5荧光分子被激活至荧光态。而后,用波长为633nm的红色激光照射待观察样品,使处于荧光态的Cy5分子发射荧光。通过电子相机读取荧光图像,采用函数拟合的方法对图像进行处理,进而确定每个荧光点的中心位置。经过足够多次数循环后对获得的荧光点位置进Z叠加,最终得到超分辨显微图像。 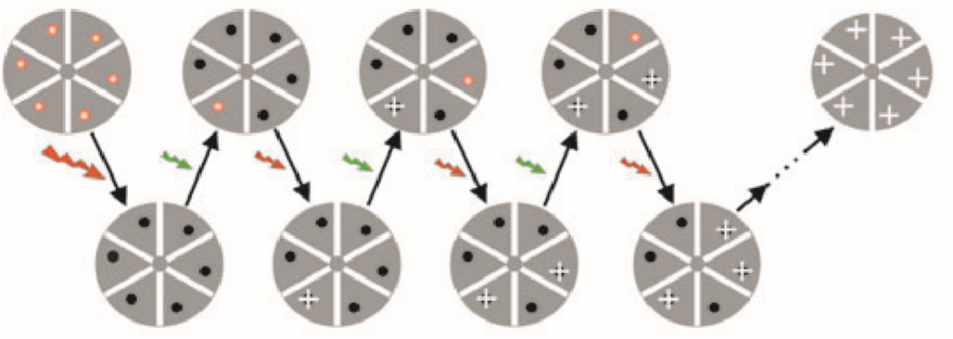
图 2 随机光学重构显微技术STORM循环原理图[3]
光路结构
PALM超分辨系统系统由如下部分组成:
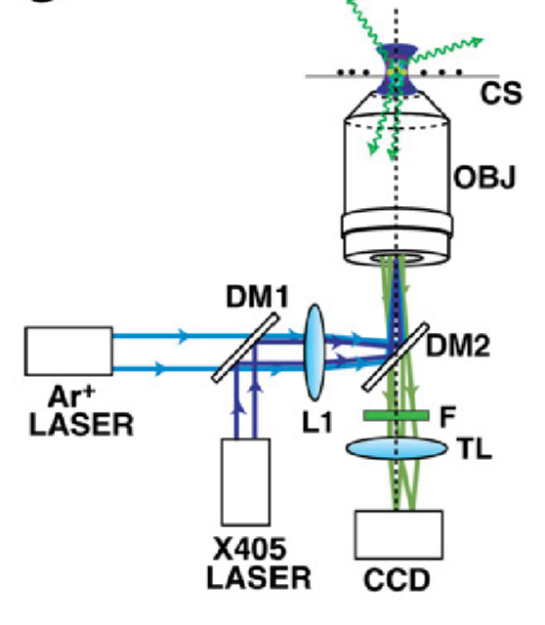
(1)倒置荧光显微镜:可以用于激光扫描共焦显微成像或者单分子PALM显微成像。
(2)半导体激光:405nm激光器作为激活光,561nm激光器作为激发光,激光器波长的选择是要和使用的光活化蛋白的特性有关,用于激发荧光的激光器波长一般包括488、561、594、635nm。激光器功率一般在50-200mW。为了光路调节的方便,一般要求激光器输出光斑质量要好。
(3)自由空间或光纤多波长耦合器:自由空间耦合器可以使得更高功率的激发和激活激光进入显微镜系统,使得成像过程可以更快。
(4)快门或AOTF(Acousto-Optic Tunable Filter声光可调滤波器):快门或AOTF的作用是切换激活光和激发光,使得激活光和激发光依次照射在样品上,实现快速光开关的目的。在空间光输入到显微镜之前,使用AOTF可以使得进入显微镜的光强最大。
(5)激发滤光片、二向色片、长通滤光片:用于收集荧光信号最大,同时阻挡激发光,使得保证信噪比,消除残余光和自发荧光。
(6)TIRFM(全内反射荧光显微镜)物镜。TIRFM物镜的作用是使光束在样品表面发生全内反射,用以提高图像的信噪比。同时TIRF物镜的数值孔径都比较大,会有比较好的光子收集效率。
(7)EMCCD或sCMOS相机。相机要在可见光范围内有较高的量子效率、较高的帧速、较低的噪声。
|
图 3 PALM显微成像光路图[5] |
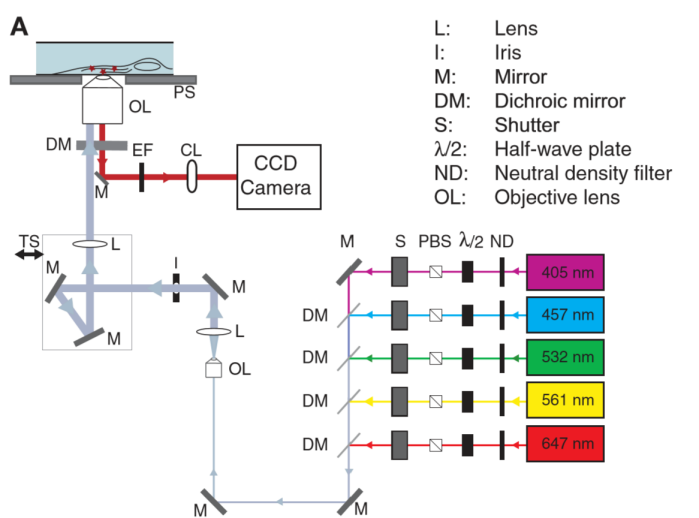
图 4 STORM显微成像光路图[6] |
随机光学重构显微镜 STORM结构:包括简单全内反射显微镜、低压连续波长激光器和光转换染料,如花青素Cy3和Cy5。
优缺点
分辨率:横向分辨率为10-30nm,轴向分辨率为10-75nm,时间分辨率可达秒量级。相比于其他超分辨显微成像技术,随机单分子定位显微显微成像的优缺点:
优点:可实现高分辨率的宽视场成像,PALM的成像方法用来观察外源表达的蛋白质,STORM用于分辨细胞内源蛋白质。
缺点:由于需要反复循环激活、成像及漂白过程,因此随机单分子定位显微时间分辨率较低[7-9]。
应用
PALM一般用于观察细胞外源表达的蛋白质,而STORM则多用于研究细胞内源蛋白质的定位。随着荧光团技术和其他相关技术的发展,这些成像差异将会变得更小。如下图为使用双色对细胞微管蛋白,肌动蛋白进行成像的结果图。

图 5 双色STORM成像结果图[10]
参考文献
[1] Imaging Intracellular Fluorescent Proteins at Nanometer Resolution[J]. Science, 2006, 313(5793):1642-1645.
[2] Rust M J.Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)[J]. Nat. Methods, 2006, 3.
[3] Bates M , Huang B , Dempsey G T , et al. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes[J]. Science, 2007, 317(5845):1749-1753.
[4] A photoactivatable GFP for Selective Photolabeling of Proteins and Cells[J],Science,2002, 297(5588):1873-1877.
[5] Hess S T , Girirajan T P K , Mason M D . Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy[J]. Biophysical Journal, 2006, 91(11):4258-4272.
[6] Bates M , Jones S A , Zhuang X . Stochastic Optical Reconstruction Microscopy (STORM): A Method for Superresolution Fluorescence Imaging[J]. Cold Spring Harbor Protocols, 2013, 2013(6):498.
[7] Sydor A M , Czymmek K J , Puchner E M , et al. Super-Resolution Microscopy: From Single Molecules to Supramolecular Assemblies[J]. Trends in Cell Biology, 2015, 25(12):730-748.
[8] 付芸,王天乐,赵森.超分辨光学显微的成像原理及应用进展[J].激光与光电子学进展,2019,56(24):21-33.
[9] 吕志坚,陆敬泽,吴雅琼,陈良怡.几种超分辨率荧光显微技术的原理和近期进展[J].生物化学与生物物理进展,2009,36(12):1626-1634.
[10] André Lampe, Haucke V , Sigrist S J , et al. Multi-colour direct STORM with red emitting carbocyanines[J]. biology of the cell, 2012, 104(4):229-237.