文章信息
作者:Karl Zhanghao, Xingye Chen, Wenhui Liu, Meiqi Li, Yiqiong Liu, Yiming Wang, Sha Luo, Xiao Wang, Chunyan Shan, Hao Xie, Juntao Gao, Xiaowei Chen, Dayong Jin, Xiangdong Li, Yan Zhang, Qionghai Dai, Peng Xi
文章名:Super-resolution imaging of fluorescent dipoles via polarized structured illumination microscopy
期刊:Nature Communications
发表日期:2019.10.16
链接:https://doi.org/10.1038/s41467-019-12681-w
摘要
荧光偏振显微镜可以观察荧光偶极子的强度和方向,在研究生物复合物的分子结构和动态中起着重要的作用。然而,现有的技术仍然难以观察亚细胞结构上偶极子的组合及其在超分辨尺度上活细胞中的动态过程。在这篇文章中,我们介绍了偏振结构光照明显微镜(pSIM),它通过在空间-角度超空间中解释荧光偶极子来实现偶极子的超分辨率成像。我们演示了pSIM对一系列生物丝状系统的应用,例如细胞骨架网络和λ-DNA,并且报告了短肌动蛋白在肌球蛋白覆盖的表面的动态过程。此外,pSIM揭示了海马体神经元的与膜相连的周期性骨架中肌动蛋白环结构的并排组织形式,并拍摄了活U2OS细胞中绿色荧光蛋白标记的微管蛋白的偶极动态变化过程。pSIM能够直接应用于多种产品化和自建的SIM系统以及多种成像模式。
系统结构图

激光器发出的激光经AOM(声光调制器)和BE(扩束装置)变成一束平行光,再经RF(反射镜)和PBS(偏振分光棱镜)反射,穿过HWP(半玻片)打到SLM(空间光调制器)上,被SLM反射后再经过HWP,偏振方向改变,透过PBS,经透镜聚焦后在mask处形成衍射图案。其中只有±1级衍射斑通过mask,然后经过两透镜组成的4F系统聚焦在OB(物镜)后焦面,经物镜折射后变成两束平行光,在样本处发生干涉形成结构光照明,激发的荧光经过物镜和TL(套筒透镜)后被相机收集。
主要结果图/视频
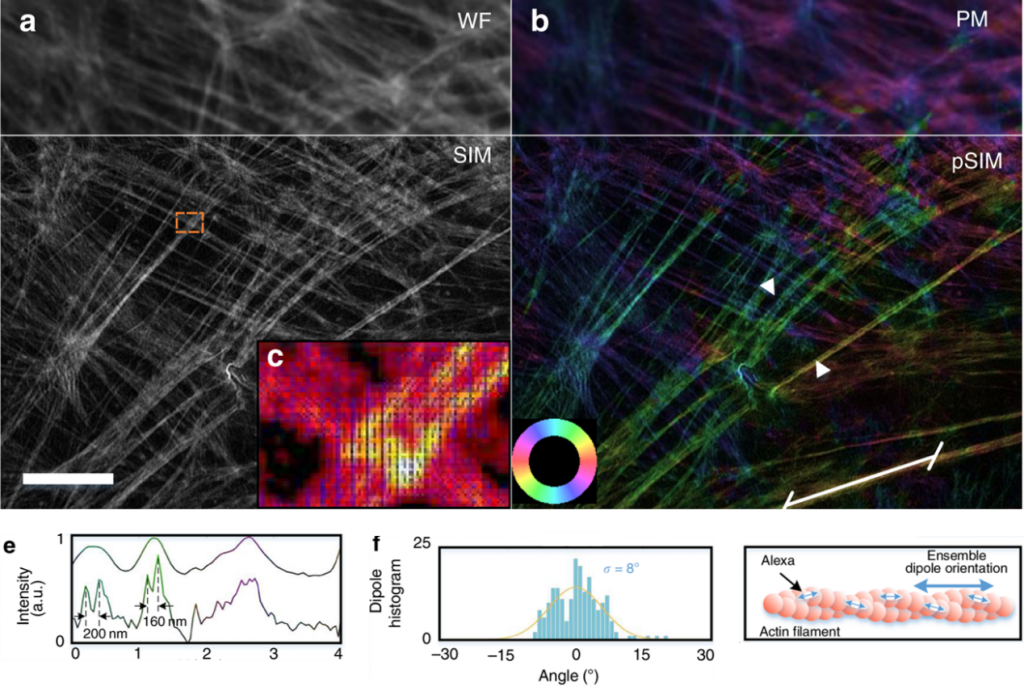
(a):宽场和普通SIM显微镜拍摄的actin(肌动蛋白)图像;(b):普通偏振荧光显微镜和pSIM对 (a) 中相同区域拍摄的图像,颜色代表荧光偶极子的方向;(c):(a) 中橙色框内区域actin的放大图,用蓝色箭头标明了荧光偶极子的方向;(e):上下两条曲线分别代普通偏振荧光显微镜和pSIM拍摄的图像中在 (b) 中两箭头之前连线上的强度和角度分布;(f):左图为pSIM拍摄图像在 (b) 中下方直线上的角度分布直方图及其高斯拟合;右图为actin上荧光蛋白分布的模拟图,虽然单个荧光蛋白的偶极矩方向与actin方向有一定夹角,但actin上均匀分布的大量荧光蛋白总得偶极矩方向与actin方向一致。Scale bar:5 μm
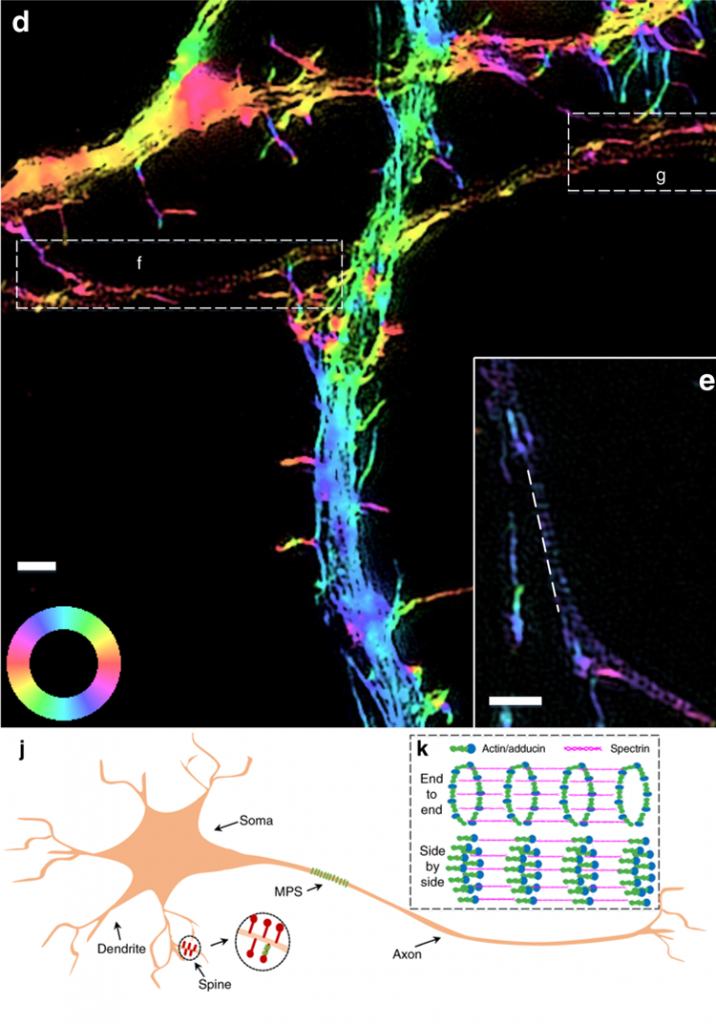
(d):actin细丝的2D-pSIM图像,颜色代表荧光偶极子的方向;(e):轴突中的actin图像;(j):神经细胞结构图;(k):End-to-end为此前人们猜想的轴突中actin的环状结构,但如果猜想成立,(d) 中荧光偶极矩的方向应与轴突方向正交,但实际实验结果是两者平行。本文据此提出了Slide-by-slide的结构模型。
亮点点评
1)SIM(结构光超分辨显微成像技术)和PM(偏振荧光显微成像技术)都是经历十几年发展,已经相当成熟的技术。这篇文章巧妙地将两种技术有机结合,弥补了普通偏振荧光显微镜分辨率不足的缺陷。
2)这篇文章中用pSIM,普通SIM,普通PM和WF显微镜对样本相同区域进行了成像,见图 2。可以看到pSIM图像相对普通SIM和普通PM拍摄的图像在不同方面有所提升,没有出现失真。文章中还在自建和商业化的SIM系统上都应用了pSIM技术,得到的结果是一致的。这些都说明了pSIM技术的可靠性。
3)神经细胞轴突中actin的环状结构是此前被人们广泛认可的理论模型,这篇文章根据pSIM对神经细胞轴突中actin的成像结果,对这一模型提出了大胆的质疑,并提出了新的模型,让人们对神经细胞的微观结构有了更深入的理解。
4)这篇文章中采用颜色来表示角度信息,这不仅让人们可以方便地从图像中获得荧光偶极子的角度信息,而且让图像的色彩更丰富。



