1 病理检测技术发展历程及展望
疾病是一个极其复杂的过程。要了解并最终征服疾病,病理学是人类必不可少的工具。病理学是一门运用各种方法研究疾病的原因(病因学),在病因作用下疾病发生发展的过程(发病学),以及机体在疾病过程中的功能、代谢和形态结构的改变(病变),阐明其本质,从而为疾病认识和治疗提供必要的理论基础的学科。时至今日,病理学越来越成为现代医学不可或缺的组成部分。
而病理学的发展,离不开病理检测技术的进步。在古希腊时代,由于没有有效的病理检测技术,虽然有名医Hippocrates和Asclepiades基于经验和哲学思辨分别提出了液体病理学和固体病理学,但并未对医疗实践起到实质的理论指导作用;直到文艺复兴之后,随着解剖学的发展,人们对人体的了解深入到器官水平,对病理的认识随之迈进了一大步,1761年意大利医学家Morgagni发表的《疾病的部位和病因》一书标志着器官病理学的创立和病理形态学的开端;一个世纪以后,随着显微镜发展成熟并应用到医学领域,病理学迎来了又一次突破,1858年德国病理学家Virchow根据对大量尸检材料的显微镜改变,提出了细胞病理学的理论,认为细胞的改变和细胞的功能是一切疾病的基础,并指出了形态学改变与疾病过程和临床表现之间的关系。
从以上病理学的发展历程不难看出,病理检测技术的发展趋势是从宏观到微观,从表象到内在。现代病理学的发展也没有脱离这一规律。
现代病理学主要有以下六大发展方向:
1、超微结构病理学——从亚细胞(即细胞器)水平观察病变;
2、组织化学和细胞化学病理学——通过检测细胞内化学成分观察病变;
3、免疫病理学——用免疫学的基本原理和方法来阐述疾病的病因和发病机制;
4、遗传病理学——从染色体畸变和基因突变的角度进行疾病的探讨;
5、分子病理学——从分子水平研究疾病的病因和发病机制;
6、免疫组织化学病理学——免疫学与组织化学相结合的方法去探讨疾病的病因、发病机制、组织发生。
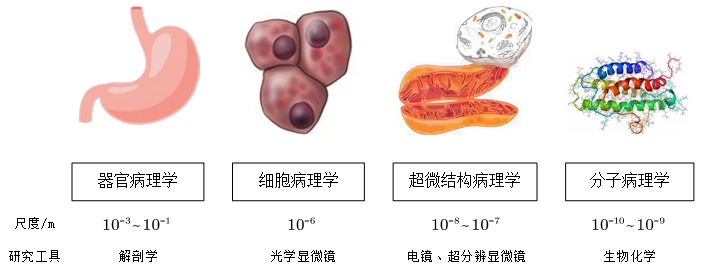
图 1 不同尺度下的病理学研究分支
总的来说,这些研究发展方向都是深入到亚细胞乃至分子尺度研究疾病的发生机理,以求更为透彻地了解疾病的微观机理,如图1所示。超微结构病理学需要从亚细胞水平,在100nm的尺度下观察病变细胞并分析致病机理,这显然这离不开成像技术的发展进步。
此前,由于光学显微镜受光学分辨率极限限制,成像分辨率最高也只能达到约200nm量级,要想深入细胞内部,在细胞器尺度探寻疾病奥秘,光学显微镜显得有些力不从心。因此目前超微结构病理学的发展主要基于分辨率能达到埃(10-10m)量级的电子显微镜,生物教科书中栩栩如生的细胞精细结构模型也正是来自电子显微镜。
但电子显微镜也有难以克服的缺点。最致命的缺点便是电子显微镜需要在真空条件下工作,无法观察活样本,这就注定了电子显微镜不能追踪发生在活细胞内的动态过程,而观察肿瘤细胞、干细胞等活细胞中的亚细胞结构动态变化过程是病理检测乃至整个医学中的重要课题。此外,电子显微镜的样本必须极薄(100nm以下),这不仅提高了制备样本的难度,也决定了电子显微镜无法对有一定厚度的生物组织进行三维成像。而且电镜只能看到细胞内的结构,对于所观察到的结构的判断,则需要其他技术辅助辨别。
面对这些难题,人们又将视线转回了光学显微镜。相比电子显微镜,光学显微镜要灵活得多,而且在荧光蛋白被发现后,光学显微镜更是如虎添翼。用荧光蛋白对细胞内感兴趣的结构进行标记并成像的荧光显微镜获得了迅猛发展,涌现了利用Pinhole滤去杂散光提高分辨率的共聚焦显微镜、用片层光照明实现快速三维成像的光片显微镜、利用双光子激发提高成像深度的双光子显微镜、利用倏逝波对细胞表层特异性成像实现高轴向分辨率的全内反射荧光显微镜等新一代荧光显微成像技术。但这些技术虽然有着各自突出的优点,却有着共同的短板:在横向分辨率上的提升有限,难以满足观察亚细胞结构的需求。
办法总比困难多,利用荧光这一利器,人们又相继发展了SMLM、STED、SIM等超分辨显微成像技术,最高能够实现纳米量级的空间分辨率,这对于亚细胞结构的成像来说已是绰绰有余。
总之,超分辨成像技术在克服了电子显微镜诸多缺点的同时,补上了空间分辨率这一光学显微镜的短板,在病理检测方向有着广阔的应用前景。当然,没有一项技术是完美无缺的,超分辨技术也不例外。每种超分辨技术都有自己的缺陷,这在投入到病理检测实践中时是必须考虑的因素。在下一个章节中,我们会分别介绍这些超分辨技术的原理、优势以及缺陷,分析其在病理检测领域的应用前景。
2 超分辨显微成像技术
2.1 SMLM技术
单分子定位显微技术(Single Molecule Localization Microscopy,SMLM)[1]是使用特定的荧光探针,用特定波长的激光来激活荧光分子,然后用另一波长的激光激发荧光分子并成像。其中,控制激光的强度,使得每一幅图像中都只有少量稀疏的荧光分子被激活。采集成千上万帧的图像以获得足够的单分子,随后利用单分子定位算法(如二维高斯拟合算法)精确定位单分子的中心位置。最后,将所得到的单分子定位点进行叠加重建,最终获得一幅超分辨图像。目前基于单分子定位显微技术的超分辨成像技术主要包括光激活定位显微技术(Photo Activated Localization Microscopy, PALM)、随机光学重构显微技术(Stochastic Optical Reconstruction Microscopy,STORM)以及由这两种技术衍生出的其它成像技术。
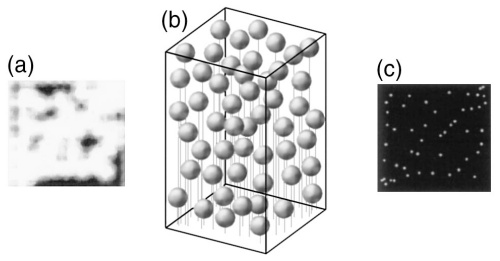
图 2 PALM原理示意图 (a)常规成像方式下获得图像,荧光分子荧光相互叠加 (b)对荧光分子加以区分,每次只对少数荧光分子成像 (c)重构后得到的超分辨图像[2]
PALM的概念在1994年首先由加州大学教授Eric Betzig提出,原理如图2所示,并且在2006年通过实验实现[3]。PALM技术结合了单分子检测技术、光激活荧光蛋白标记技术以及单分子定位算法,将显微技术的定位精度提高到20nm以内。与此同时,哈佛大学教授庄小威提出了STORM技术,其原理与PALM技术基本相同,同样利用单分子检测技术和单分子定位算法提高显微技术的定位精度,这两种技术的区别在于PALM技术利用荧光蛋白的光激活效应实现开关,而STORM技术利用荧光探针和免疫荧光技术进行标记[4]。PALM技术通过细胞自身表达荧光蛋白的方式进行成像,因此更适合用于活细胞内蛋白的超分辨成像。2007年,Betzig等人将PALM显微技术应用于记录两种蛋白质的相对位置[5],并且在次年开发出可用于记录活细胞中细胞黏附蛋白的动力学过程的PALM成像技术[6]。2007年,STORM技术实现了多色成像,在原有的Cy3~Cy5荧光分子对的基础上,发展了不同荧光分子对,Cy3与一系列荧光分子在不同波长激光激发下产生不同的荧光,可以用来实现多色荧光成像分析,同时记录两种甚至多种蛋白质的空间相对位置[7]。此后SMLM技术的发展主要集中在荧光蛋白和单分子定位算法的改进上。目前已有商业化的SMLM显微镜产品出现,如图3所示。
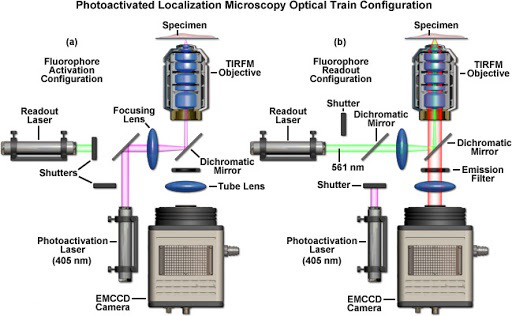
图 3 蔡司商业化PALM显微镜系统示意图 (a)405nm激光激活部分荧光分子 (b)561nm激光激发激活的荧光分子进行成像
SMLM技术的主要优势在于能实现很高的空间分辨率(横向分辨率小于20nm,纵向分辨率小于50nm)。但是SMLM技术需要成百上千幅原始图像来重构出一幅超分辨图像,因此其时间分辨率较低,大约在几秒到几分钟一帧的量级。这大大限制了SMLM技术在跟踪记录细胞内超微结构的动态生命活动中的应用,因此这些技术在病理检测领域也难以获得重用。
2.2 STED技术
受激发射损耗显微技术(Stimulated Emission Depletion Microscopy, STED)利用荧光饱和态与激发态的受激损耗的非线性关系,通过构造特殊空间结构的激发光和损耗光来实现超衍射极限的分辨率,其中损耗光的波长大于激发光的波长。激发光照射被荧光标记的样品,使样品发出荧光,另一束损耗光通过相位调制形成中空型的光圈,光圈将激发光斑焦点外围的荧光淬灭,通过减小有效荧光发光面积,减小系统点扩散函数,实现超分辨,其原理如图4所示。
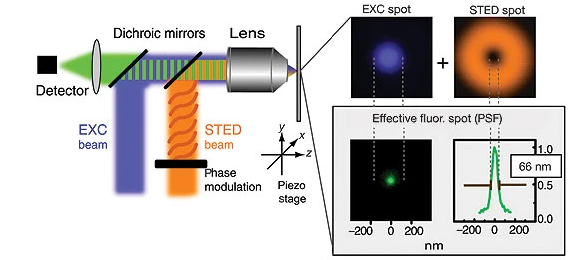
图 4 受激发射损耗显微技术原理[8]
1994 年,德国马普所教授Stefan W.Hell首次提出受激发射损耗(Stimulated Emission Depletion,STED)显微技术,计算出理论分辨率35nm[9]。1999年Hell和Thomas等人首次在实验上验证了受激发射损耗显微技术,在横向分辨率上突破了衍射极限,分辨率为106nm。此后经过不断改进,STED显微镜的横向分辨率达到了20~70 nm,轴向分辨率达到了40~150 nm,时间分辨率达到毫秒量级。
STED显微技术的主要优势在于无需进行后续的图像处理、分辨率高且成像速度快。但是STED技术要实现高的空间分辨率,需要在样本上施加强度较大的损耗光,而增加损耗光强同时也会对荧光样本造成光漂白和光毒害,如果用于活细胞成像可能会损伤细胞,因此不适合用于活细胞的观测。此外,STED技术采用聚焦光束扫描成像的方式,难以同时对较大视场范围内的生物样本进行快速成像。以上两点缺陷决定了STED技术在病理检测领域很难有用武之地。

图 5 STED显微镜系统图[10]
2.3 SIM技术
结构光照明显微技术(Structured Illumination Microscopy,SIM)的基本思想是由荧光标记的生物样品被周期性的结构光照明, 被测样品与照明图案两个高频信号图案的叠加产生低频可测的莫尔条纹,如图6所示,而照明图案的频率已知,从而可以解算出未知样本的高频信息,进而通过逆傅里叶变换获得样本的空域图像,以此实现超高分辨率成像。其原理如图6所示。

图 6 SIM原理示意图 (a)两种高频条纹重叠产生低频的莫尔条纹 (b)传统显微成像系统在频域内收集信息能力受OTF(光学传递函数)限制 (c)周期性照明光在频域空间内对应于两个点 (d)上下两个圆内的频域信息受照明光调制,进入系统OTF范围 (e)SIM系统能收集到的频域信息范围,半径可达原本系统OTF的两倍[11]
结构光照明显微技术最早在1999年由伦敦大学国王学院的Heintzmann研究小组提出,他们详细地描述了此方法的物理原理及实现超分辨图像重构的步骤。该方法利用结构光频率和样品频率分量形成的莫尔条纹,即将原本不可分辨的高频空间信息编码入荧光图像中,来提高横向空间分辨率[12]。2000年,加州大学教授Gustafsson等人在实验上得到了约为115nm的横向空间分辨率,将成像分辨率提高到了衍射极限分辨率的2倍[11]。2008年实现了三维的结构光照明超分辨荧光显微成像(3D-SIM),横向与轴向的成像分辨率都提高到了传统光学荧光显微镜衍射极限分辨率的2倍[13]。同年,该研究小组还将结构光照明技术与双向照明的I5M技术结合,获得了三维成像分辨率都优于100nm的成像结果[14],使得人们对活细胞及细胞内部各种细胞器的三维超分辨成像成为可能。
由于线性结构光照明只能将成像分辨率提高到2倍,即该方法本质上仍然受到阿贝衍射极限的制约。为了进一步提高成像空间分辨率,将结构光照明显微技术与荧光分子激发态饱和效应相结合,将荧光发射图案中以结构光照明空间频率为基频的高次谐波与样品中的高频信息叠加同样产生了莫尔条纹,将空间分辨率提高到50nm左右,此技术被称为饱和结构光照明显微镜(SSIM)[15]。由于荧光饱和需要极高的激发光强,从而加速了对样品的光漂白且易产生光损伤,阻碍了其在生物研究中的应用。
此后,为了能够降低激发光强且同时实现非线性结构光照明,人们想到了利用可逆光转换荧光蛋白Dronpa代替实现荧光饱和。荧光蛋白Dronpa的主、次激发峰分别位于503和390nm处,发射峰位于518nm处。当用蓝光(488nm)激发Dronpa时,Dronpa发出荧光并转换到“关闭”状态, 当用紫色激光(405nm)照明时,Dronpa恢复到“打开”状态。Dronpa这种在非常低的照明功率(1~10 W/cm2)下的“开”和“关”状态的转换可循环超过100次,但发射的荧光强度逐渐减小(~75%)。在2012年Gustafsson研究小组利用Dronpa观测了固定细胞中的纯化的微管、核孔复合物和肌动蛋白纤维,实现了约50nm的空间分辨率,同时将所需激发光强降低了6个数量级,揭示了活细胞成像分辨率优于50nm的可能性,该方法被称为基于非线性结构光照明显微术(NL-SIM)[16]。
除了分辨率,SIM技术在其他多个方向也实现了突破和创新。由于结构光照明显微技术是通过将多幅图像重构出一幅超分辨图像,而且采集图像过程中照明图案移动的距离必须小于空间分辨率以防止在超分辨图像重建过程中产生运动伪影,早期的SIM系统时间分辨率较低不能满足活细胞成像的需要。随后的研究中,人们采用液晶空间光调制器代替之前的物理光栅来产生结构光照明,无需机械移动任何光学元件,仅需改变空间光调制器中液晶的方向,可在1ms内产生所需的照明图案,大大提高了系统的时间分辨率和稳定性,从而满足了活细胞的超分辨显微的需要。加州大学的Kner等人和霍华德休斯医学研究院的Shao等人分别实现了约100nm分辨率的二维和三维结构光照明活细胞超分辨成像[17, 18]。
但是在SIM系统中,还有一个器件限制了系统整体的成像速度——偏振旋转器(PR)。PR需要随着照明图案的方向切换改变照明光的偏振方向,此前SIM系统中普遍采用液晶相位可变延迟器和四分之一玻片的组合来实现偏振旋转器的功能,但是液晶相位可变延迟器的响应时间长达20ms,这大大阻碍了SIM系统成像速度的提升。北京大学陈良怡组研发的新一代HiS-SIM系统采用六片式二分之一玻片构成的偏振光旋转器,不需要任何时间就能实现不同方向照明图案下偏振态的切换,将系统的超分辨成像时间分辨率提高到了188Hz。HiS-SIM系统原理如图7所示。
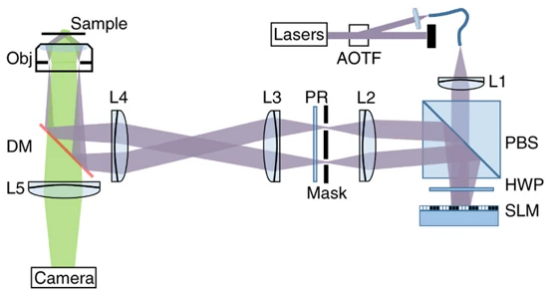
图 7 HiS-SIM系统原理图[19]
SIM技术的主要优势在于:(1)对于样本的要求相对于其他超分辨显微技术低,无需特殊的荧光蛋白,制备过程简单,任何在宽场荧光显微镜中使用的荧光样本均可以在SIM中使用;(2)SIM可以与TIRF、共聚焦转盘显微镜等其他显微技术结合,满足不同成像需求;(3)需要的照明强度较低,光毒性和光漂白效应小。SIM技术的缺点主要体现在SIM的图像重构算法较为复杂,重构后的图像容易出现伪影。
3 超分辨技术在活细胞成像及病理检测中应用进展
由于超分辨技术还很年轻,只有20多年的历史,目前实际进入医学病理检测实践中的例子还很少。但是在与病理检测关系密切的活细胞成像领域,超分辨技术已经大展拳脚。
比利时鲁汶大学的Vangindertael研究组通过将PALM技术与共焦显微成像结合,发明了共焦相关PALM(ccPALM)技术,克服了解剖学背景对多细胞生物成像的限制。利用这项技术,他们观察到秀丽隐杆线虫中的离子型谷氨酸受体分布,分辨率达到20nm,揭示了受体簇的超分辨率结构,并将其映射到动物的神经元上,实现了在生理学相关的背景下解剖具有单分子分辨率的生物结构[20]。但是受限于PALM的低时间分辨率,他们没能观察到这一结构在线虫运动过程中的动态变化。
STED技术与自适应光学的结合产生了意想不到的化学反应。牛津大学Patton研究组研发的双自适应3D-STED光学系统用一个变形镜同时消除三个光路中的色散,让变形镜表面的起伏随波前的变化而改变,从而校正每个波长的相位。再用空间光调制器 (SLM) 进行光束整形相位掩模,由于DM的分辨率较低,表面形状受执行机构的限制,而SLM分辨率较高,能够产生更复杂的相位分布,因此用SLM来校正DM无法消除的残余像差,从而使STED对厚组织样本的成像性能得到改善。Patton等人用这种方法演示了黑腹果蝇大脑中复杂结构的三维STED成像[21]。美中不足的是,由于STED技术光毒性强的缺点,他们没能实现对果蝇大脑的连续长时程成像,而这对探寻神经结构的奥秘是必不可少的。
北京大学陈良怡研究组对SIM显微成像技术加以升级改造研发的新一代HiS-SIM显微镜让我们对细胞的能量工厂——线粒体有了全新的认识。线粒体介导了离子平衡、能量代谢、细胞信号转导、细胞程序性死亡等重要过程,是生物医学研究中最热门的领域之一。而线粒体内嵴富集维持线粒体氧化呼吸功能相关的线粒体蛋白,又是线粒体研究的重点。尽管STED、PALM/STORM等超高分辨率显微镜具备足够的理论分辨率,但是它们都无法观察到线粒体的内嵴结构以及在活细胞内的动态变化过程,最主要的原因是因为线粒体对光毒性非常敏感,采集到一般超高分辨率成像所需要的光子时,相关结构就已经被光毒性所破坏了。HiS-SIM显微镜首次在活细胞中清楚的观察到了线粒体内嵴的结构,以及两个线粒体融合时,或者是单个线粒体分裂时内嵴的活动,并观察到单个静息线粒体内内嵴融合的重组装过程[19]。HiS-SIM系统还融入了TIRF显微成像技术,可以方便地切换到TIRF-SIM成像模式,获得细胞膜附近的超分辨率图像,追踪膜表面的动态过程。此外,陈良怡教授还与北大第一医院的王静敏教授合作,用HiS-SIM系统对正常人和佩梅病患者体内分离出的成纤维细胞内的线粒体分别进行成像,观察到了显著差异。这是超分辨技术进入医学病理检测领域的一次宝贵实践,也为人类战胜佩梅病这种不治之症带来了一丝曙光。目前HiS-SIM显微镜已经进入了产业化阶段,由广州超视计生物科技有限公司负责。如需了解HiS-SIM的更多信息,可联系泮桥的客服人员。
参考文献
[1] Yildiz, A., et al., Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science, 2003. 300(5628): p. 2061.
[2] Betzig, E., Proposed method for molecular optical imaging. Opt. Lett., 1995. 20: p. 237-239.
[3] Betzig, E., et al., Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science, 2006. 313(5793): p. 1642.
[4] Rust, M.J., M. Bates, and X. Zhuang, Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods, 2006. 3(10): p. 793-796.
[5] Shroff, H., et al., Dual-color superresolution imaging of genetically expressed probes within individual adhesion complexes. Proceedings of the National Academy of Sciences, 2007. 104(51): p. 20308.
[6] Shroff, H., et al., Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nature Methods, 2008. 5(5): p. 417-423.
[7] Bates, M., et al., Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science, 2007. 317(5845): p. 1749.
[8] Willig, K.I., et al., STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature, 2006. 440(7086): p. 935-939.
[9] Hell, S.W. and J. Wichmann, Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Optics Letters, 1994. 19(11): p. 780-782.
[10] Luwei, W., et al., Aberration correction for improving the image quality in STED microscopy using the genetic algorithm. Nanophotonics, 2018. 7(12): p. 1971-1980.
[11] Gustafsson, M.G.L., Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy, 2000. 198(2): p. 82-87.
[12] Heintzmann, R. and C.G. Cremer, Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Europe '98. Vol. 3568. 1999: SPIE.
[13] Shao, L., et al., I<sup>5</sup>S: Wide-Field Light Microscopy with 100-nm-Scale Resolution in Three Dimensions. Biophysical Journal, 2008. 94(12): p. 4971-4983.
[14] Gustafsson, M.G.L., et al., Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophysical journal, 2008. 94(12): p. 4957-4970.
[15] Gustafsson, M.G.L., Nonlinear structured-illumination microscopy: Wide-field fluorescence imaging with theoretically unlimited resolution. Proceedings of the National Academy of Sciences of the United States of America, 2005. 102(37): p. 13081.
[16] Rego, E.H., et al., Nonlinear structured-illumination microscopy with a photoswitchable protein reveals cellular structures at 50-nm resolution. Proceedings of the National Academy of Sciences, 2012. 109(3): p. E135.
[17] Kner, P., et al., Super-resolution video microscopy of live cells by structured illumination. Nature Methods, 2009. 6: p. 339.
[18] Shao, L., et al., Super-resolution 3D microscopy of live whole cells using structured illumination. Nature Methods, 2011. 8: p. 1044.
[19] Huang, X., et al., Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nature Biotechnology, 2018. 36: p. 451.
[20] Vangindertael, J., et al., Super-resolution mapping of glutamate receptors in C. elegans by confocal correlated PALM. Scientific Reports, 2015. 5(1): p. 13532.
[21] Patton, B.R., et al., Three-dimensional STED microscopy of aberrating tissue using dual adaptive optics. Optics Express, 2016. 24(8): p. 8862-8876.





