文章名称:Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy
发表期刊:Nature Biotechnology
发表日期:2018年4月
1 摘要
为了增加超分辨率(SR)显微镜的时间分辨率和最大成像时间,我们开发了一种基于Hessian矩阵的结构光照明显微技术(SIM)的反卷积算法(Hessian-SIM)。它利用生物结构在多个维度上的连续性作为先验知识来进行图像重建,并以小于传统SIM技术10%的光子剂量可获得伪影最少的SR图像,并在低信号下明显优于现有算法。Hessian-SIM可以在时间分辨率为88 nm和188 Hz的条件下实现内质网中运动囊泡或环的快速成像。其高灵敏度可以使用暗恢复时间后亚毫秒级的激发脉冲来减少荧光蛋白的光漂白,从而可以保证活细胞内长达一小时肌动蛋白丝的超分辨成像。最后,我们观察到线粒体内嵴的动态过程和一些目前未曾观察到的结构,例如囊泡胞吐过程中融合孔的扩大。
2 系统结构图
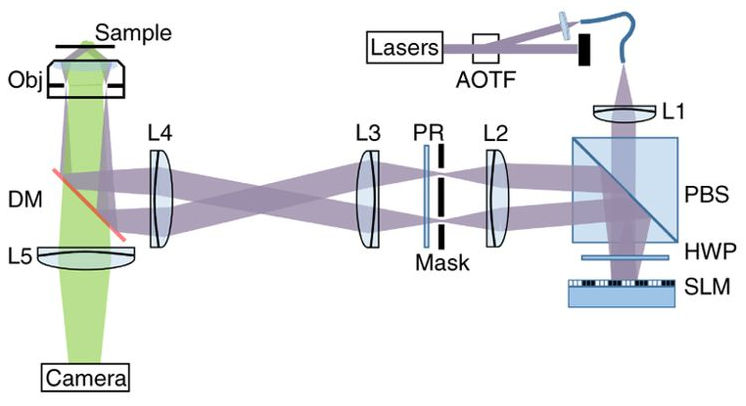
图 1 Hessian-SIM系统原理示意图
如图1所示,多色激光由激光器产生,经声光可调谐器(AOTF)选通单色,入射光通过空间光调制器(SLM)产生两束相干光,经偏振旋转片(PR)调制并通过物镜在物面形成结构光干涉条纹照明,荧光信号则由面阵相机进行接收成像。图中PBS表示偏振分束器,HWP表示半波片,DM表示二向色镜。
3 Hessian-SIM系统应用实例
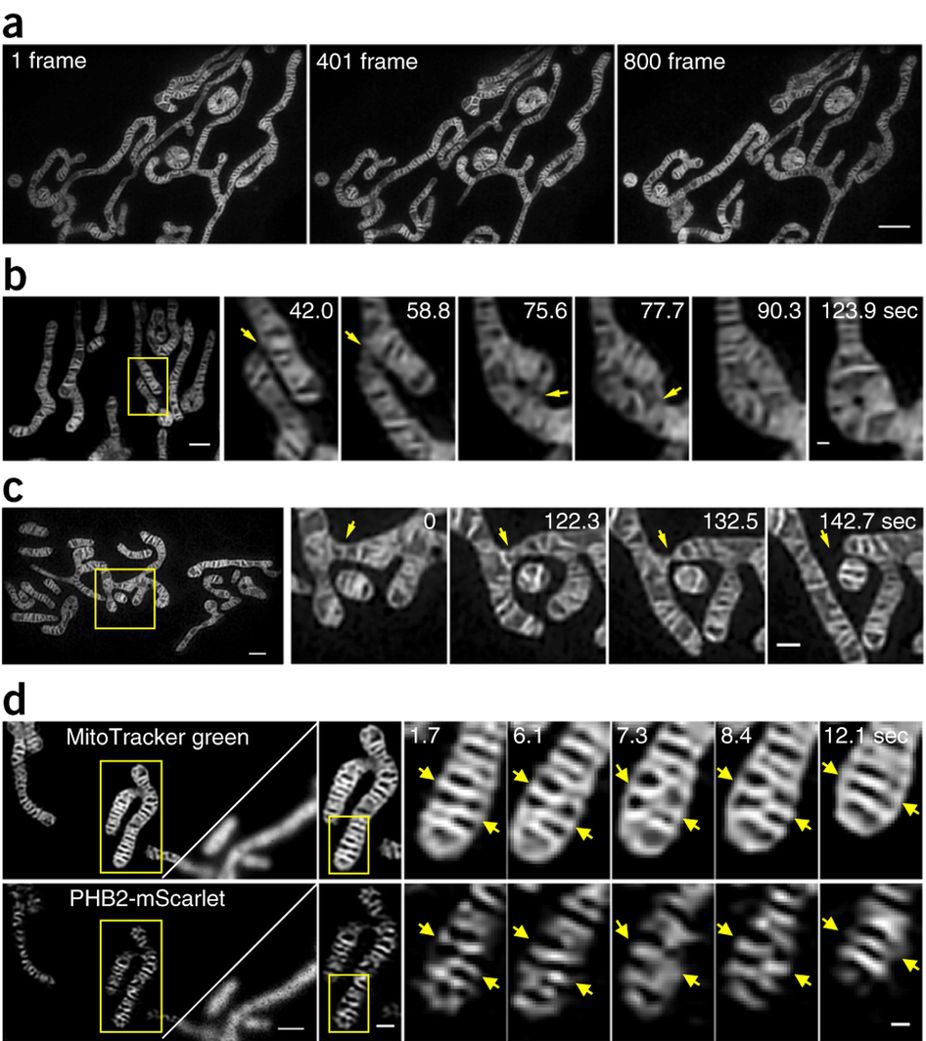
图 2 使用Hessian-SIM系统对活细胞线粒体内嵴的结构动力学成像
应用Hessian-SIM系统,我们实现了细胞“能量工厂”线粒体的超快超分辨成像,首次在活细胞中解析线粒体融合、分裂时内嵴的活动,以及线粒体内嵴自身的重组装过程。如图2所示,对照组COS-7细胞(图2a–c)和用PHB2-mScarlet转染的COS-7细胞(图2c)中的线粒体均用MitoTracker Green标记,并通过Hessian SIM的2D-SIM模态进行成像。左侧图像中的方框区域在右侧定时蒙太奇图像(图2b–d)上放大显示。图2a:活细胞线粒体的800张SIM图像序列内三个时间点上的定时成像。图2b:两个线粒体的融合始于不同线粒体中内嵴的接触。图2c:线粒体的一次裂变。图2d:单个非融合线粒体中的内嵴融合,其中两个内嵴聚合为一个。左面板右上角的三角形显示宽视场图像。这凸显出超灵敏海森结构光显微镜对于观察光毒性敏感的细胞器如线粒体动态结构方面的独特优势。
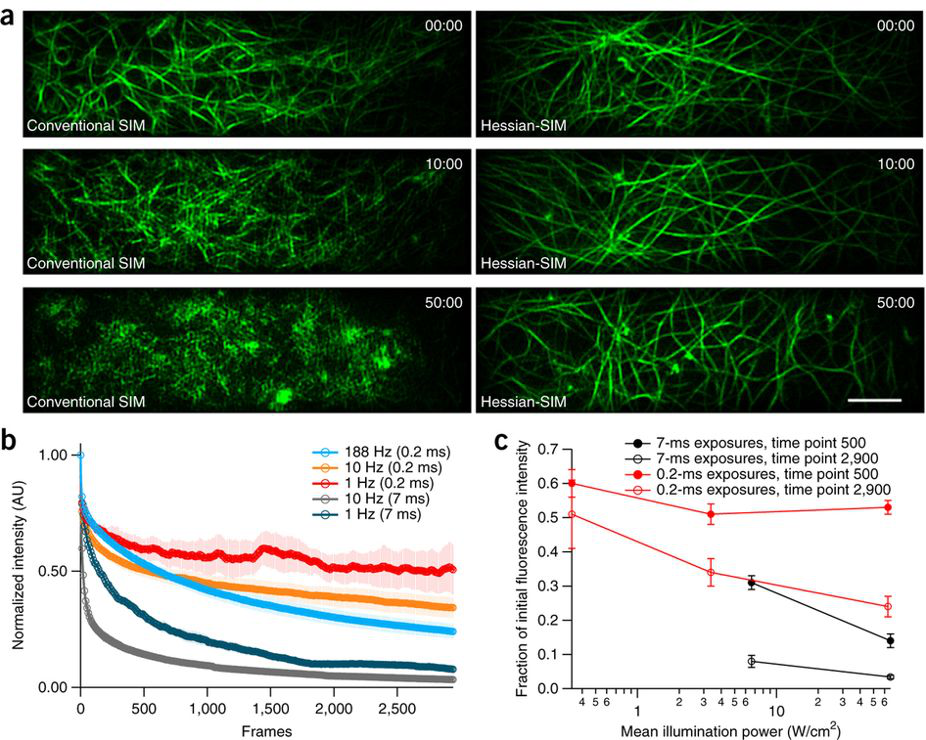
图 3 海森结构光显微镜记录长时间的微丝网络的变化
应用Hessian-SIM系统能实现活细胞超长时间无漂白成像。我们同样观察表达lifeact-EGFP的人脐静脉内皮细胞,比较在1 Hz成像速度模式下传统7 ms曝光以及维纳反卷积模式和0.2 ms曝光以及海森反卷积模式。我们发现,虽然同样是1Hz成像,传统的结构光成像大约50张后漂白就非常严重,重组出来的超高分辨率图像就全是伪迹;而超短曝光的海森结构光成像一小时,仍然有非常强的lifeact-EGFP信号,重组出来的超高分辨率图像与实验开始时无明显差别(图3a)。进一步定量化发现,超短曝光的海森结构光成像的第500帧到3000帧中lifeact-EGFP基本不变化,暗示光漂白几乎可以忽略(图3c)。这个结果表明,应用超短曝光的海森结构光显微镜,我们首次实现在活细胞上长时程、光毒性极小的超高分辨率成像,有着广泛的应用前景。
4 亮点点评
Hessian-SIM系统实现了低信噪比条件下活细胞的快速、长时程、超分辨成像,为超分辨率观测活细胞内部动态活动提供了强有力的成像工具,其低光毒性、超分辨率、高速成像的特点使得亚细胞器结构的活体长时程观测成为可能。在系统结构上,通过高数值孔径物镜、自主设计的偏振旋转器和时序控制程序等提高光子收集能力,减少采样时间,实现图像的超高速采集。在算法上,首次提出了基于时空连续的海森正则项,利用细胞结构时空连续而噪声不连续的特点,实现了高质量的超分辨重建。这些创新性技术令其成像性能在超分辨成像领域遥遥领先。利用Hessian-SIM系统首次在国际上实现观测到的线粒体内嵴融合以及囊泡快速分泌全过程,也获得了国际学者们的一致肯定,其入选2018年中国光学十大进展(应用研究类)也证实了Hessian-SIM系统对超分辨显微技术的发展有着极大的推动作用。
参考文献
Huang X, Fan J, Li L, et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat Biotechnol. 2018;36(5):451-459.





