文章名称:Observing the cell in its native state: Imaging subcellular dynamics in multicellular organisms
发表期刊:Science
发表日期:2018年4月
1 摘要
真正的亚细胞动力学生理成像需要研究其亲代生物内的细胞,因为在那里存在所有驱动基因表达的环境线索,因此也存在我们实际观察到的表型。全面理解其过程还需要高时空分辨率对细胞及其周围环境进行体成像,且对两者不造成过大的压力。我们将晶格光片显微技术与自适应光学技术相结合,实现跨细胞大体积下亚细胞过程的非侵入式无像差成像,包括内吞作用、有丝分裂、免疫细胞和体内转移性癌细胞的迁移过程。该技术揭示了细胞内跨不同生物体和发育阶段的表型多样性,为研究癌症和其他疾病的科学家们研究细胞如何运动并适应不同的生理环境提供了新视角。
2 系统结构图
AO-LLSM显微成像系统如图1所示。成像激光由可见光激光器产生,经空间光调制器(SLM)调制后在激发物镜(EO)前实现晶格光片照明,荧光信号经探测物镜(DO)接收后到达相机表面成像。双光子激光器为像差探测及校正提供光源,通过可变形反射镜、空间光调制器及波前传感器等自适应光学元器件实现样本无像差成像。插图中SH表示样品架。
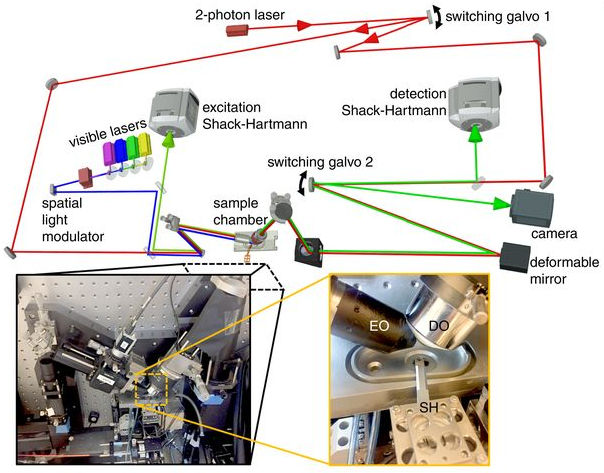
图 1 AO-LLSM显微成像系统示意图
3 应用示例
研究人员利用AO-LLSM显微成像系统,能够窥视生物体的内部,以前所未有的3D分辨率观察细胞间的相互作用。例如,应用AO-LLSM显微成像系统对活体斑马鱼胚胎(96 hpf, PM-EGFP)尾部进行成像。图2A:像差校正后的体成像,成像视场大小213×213×113 μm,每个像差独立校正子体积为7×7×3的瓦片。图2B:在3 μm厚样本的最大灰度值正交投影图像中看到的校正增强效果,每列从左至右依次为无AO情况,全局应用的基于中心瓦片的AO校正情况和每个独立瓦块AO校正情况。插图在较高的放大倍数下比较中心图块(橙色框)与边缘图块(蓝色框)的校正效果。瓦片边缘以白色显示。图2C:实际成像中用5×4×7校正瓦片测量的激发像差(左列,顶部)和探测像差(左列,底部),通过AO校正后,可在170×185×135 μm范围内实现近衍射极限成像,样本为斑马鱼胚胎脊柱(30 hpf)(左列,中心)。红色和绿色箭头分别表示穿过脊索前后固定瓦片的激发像差。黄色箭头表示在样品深处有较大探测像差的瓦片。AO校正前(中间一列)后(右一列)的正交切面图像显示随着成像深度增加,像差增加但仍可恢复高分辨率成像。图2D:以30分钟间隔的3个时间点上进行的斑马鱼胚胎脊柱像差校正的体积成像,成像视场大小156×220×162 μm,图两侧为在这些时间点上对应的激发和探测像差,其中绿色表示该时间点上已进行像差校正的图块。

图 2 AO-LLSM显微成像系统大体积成像
AO-LLSM显微成像系统可以在天然多细胞环境下,以高时空分辨率研究活细胞的三维动态过程,包括(从左上方顺时针方向)脊髓轴突的生长、癌细胞新陈代谢、细胞集群移动、胞吞、微管移位、免疫细胞迁移和(中央)细胞器动态过程(图3)。

图 3 在体活细胞的高分辨率成像
4 亮点点评
AO-LLSM显微成像系统率先将光片调制照明技术及自适应光学技术结合应用,实现了生物体内多种亚细胞动态过程的三维高分辨率成像。晶格光片技术是近年光片照明技术发展的变种,可提供相比传统光片技术更高的空间分辨率,而自适应光学技术则可以解决生物成像中深层成像及组织散射等像质问题,AO-LLSM通过巧妙的光学系统设计,将两种技术充分集成,精确重建出生物活体三维结构及动态过程,为目前生物光学显微成像的技术发展提供范式。其成像结果向读者们展示了不同尺度下的活细胞或组织内部复杂精密的动态调控及互作过程,充分显示了AO-LLSM的成像性能。
参考文献
Tsung-Li Liu et al. Observing the cell in its native state: Imaging subcellular dynamics in multicellular organisms. Science. 2018;360(6386): p. eaaq1392.



