定义
超声靶向微泡破坏(UTMD)是一种超声治疗技术,可用于将生物活性分子(包括治疗基因)定向特异性递送至超声可及的靶器官。利用低频超声与微泡结合以触发微泡空化,导致微泡附近的生物膜通透性增加,使药物分子或基因更容易穿透血管递送至细胞内,提高药物分子在病灶区域的生物利用率或基因的转染效率。同时,微泡是一种优良的递送载体,不仅可以保护药物分子或基因在运输过程中免受内源性清除,还能够通过惯性空化作用在病灶区域进行受控释放。
UTMD技术的定义
UTMD技术是指经超声图像确定载基因或药物的微泡到达靶组织或器官后,给予不同强度的超声辐照,致使微泡发生收缩、振荡、膨胀及破裂,其产生的空化与声孔效应使细胞膜形成小孔,进而促进外源性基因或药物的靶向运输[1]。
UTMD技术进行生物活性分子递送的生物物理机制
现阶段的研究认为UTMD递送药物与基因的生物物理学机制主要涉及空化效应 (cavitation) 及声孔效应(Sonoporation)、内吞作用 (endocytosis) 与声辐射力 (acoustic radiation force)[2]。
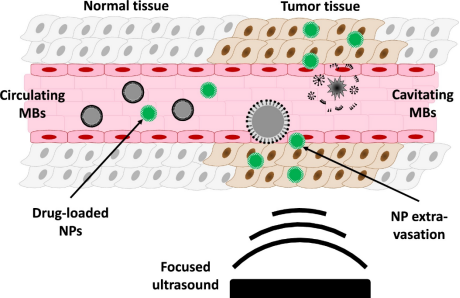
图 1 通过超声靶向微泡破坏(UTMD)进行超声药物递送。静脉内注射微泡,并在血管系统中自由循环。在使用聚焦换能器进行超声辐照后,肿瘤脉管系统中的微泡会发生空化,从而导致内皮细胞连接处破裂,细胞膜穿孔和组织通透化。药物分子更容易渗透到肿瘤组织中,从而增加了局部药物浓度。
空化效应 (cavitation)
超声波空化效应是指存在于液体中的微气核空化泡在声波的作用下振动,当声压达到一定值时发生的膨胀、坍缩和破裂的动力学过程。空化效应包括稳定空化与惯性空化:稳定空化是指在较低声压的超声辐照下微泡随声压变化而交替地膨胀-收缩,产生剪切力较小的微流射;惯性空化是指在较高声压的超声辐照下微泡过度膨胀后坍缩至破裂的过程,在微泡破裂的瞬间会在局部产生高温与剪切力较大的微流射,同时产生自由基等活性物质。
声孔效应
在惯性空化的瞬间对周围的血管壁与细胞膜产生巨大的剪切力,导致血管内皮细胞之间的间隙增大,细胞膜表面通透性增加并形成孔隙,该过程称为声孔效应。细胞膜通透性的永久性增大还是暂时性增大通常与微泡浓度和超声参数有关。细胞膜通透性的永久性增大往往意味着细胞损伤的造成,通常用来杀死癌症细胞[3],但同时也可能对健康组织带来副作用;而细胞膜通透性的瞬时性增大是UTMD技术介导生物活性分子递送的主要机制。
UTMD技术递送生物活性物质的主要形式
图2中描述了使用UTMD来递送生物活性物质的各种概念:(a)在微泡制备过程中掺入生物活性物质,从而潜在地将药物或者基因掺入微泡壳或内腔中;(b)将制备好的微泡与生物活性物质一起共孵育,从而使活性物质附着在微泡壳上,这种连接通常是静电或弱的非共价相互作用;(c)微泡与生物活性物质混合注射至血管中,只有在超声焦点处才能利用增加的细胞和毛细血管通透性促进药物递送[4]。(a)(b)两种递送方式与(c)相比,有明显的优势:首先(c)只能提高靶点的药物递送量,但全身毒副作用依旧存在;其次将生物活性分子负载在微泡上,可以大大降低在运输过程中被内源性地清除。
在分子水平上,可以使用各种物理化学方法将生物活性物质负载在不同的微泡上。如图3所示:(A)如果使用阳离子脂质或变性蛋白质,则带电的治疗剂(例如DNA,RNA)可以通过静电耦合附着在微泡外表面;(B)两亲性的分子可以掺杂在磷脂微泡的单层中;(C)在声活性脂球内部油层中掺入高度疏水的生物活性分子;(D)与次级载体连接的MB,这种方法可以同时增加载量和转染效率;(E)将药物分子包封在涂有生物相容性材料(例如明胶)的可生物降解的聚合物壳中,这种MB也被称为“双乳化微胶囊”[5]。
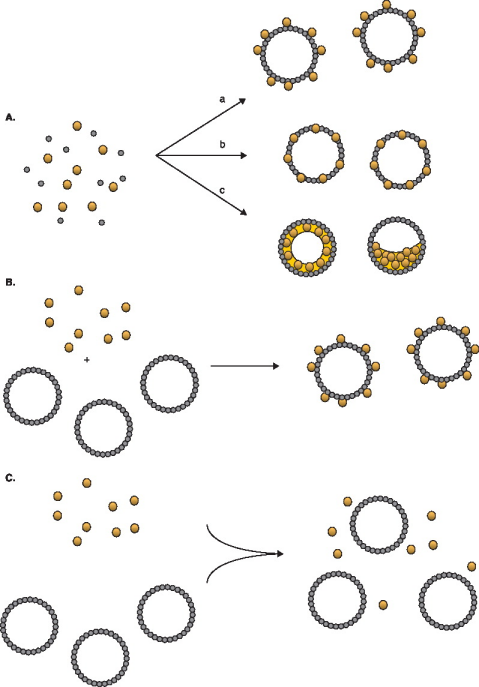
图 2 UTMD技术不同的递送概念

图 3 不同治疗物质载荷形式下的分子机制
UTMD的具体实施实例
目前UTMD技术的引导方法主要有两大类,一类是利用MRI进行引导,一类是利用超声成像进行引导。
UTMD用于心血管疾病
在心血管疾病中,药物的全身毒性是不是要害问题,因此,UTMD主要用于心脏疾病的基因治疗。越来越多的工作关注UTMD递送基因的原因主要有三点:(1)基因治疗,可能只需一次治疗即可实现治疗效果,而大多数药物需要重复使用;(2)较低的有效载荷就足以满足治疗,因为转基因的表达将增强其作用;(3)虽然大多数药物可以全身给药,但基因治疗载体大多必须局部给药。
Castle等[6]在其工作中,通过超声引导利用UTMD技术向肝脏中递送ApoA-I质粒治疗心血管疾病。在该工作中,U TMD系统由Vivid E9(GE Healthcare Systems)组成,允许定制的声脉冲参数。高频线性阵列探头(GE Healthcare Systems,12 L)用于超声检查确认肝脏的位置和灌注情况;低频心脏探头(3S,GE Healthcare Systems)用于产生聚焦超声波诱导微泡爆破。具体的实施方法为:注射微泡后,先利用高频探头进行成像15–20 s,此时的机械指数较低MI <0.4 MI;目测肝脏关注完全后,改用低频探头击破微泡,此时MI较高MI≤1.3,保持2 s;接着继续利用高频探头进行成像15–20 s,以此循环两分钟完成治疗。
UTMD用于打开血脑屏障BBB
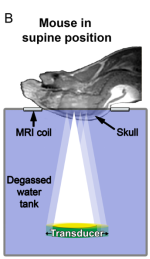
图 4 小鼠MRI引导聚焦超声系统示意图
多项研究表明,在没有或仅有有限的组织学(即微出血,巨噬细胞浸润)或功能损害(即行为和视力缺陷)的情况下,可以通过UTMD技术可靠且反复地实现打开BBB[7]。在超声处理过的脑组织中未检测到组织损伤,因此表明该方法具有良好的整体安全性。Jordão JF等[8]的工作在MRI指导下利用UTMD技术将抗Aβ抗体成功交付到BBB短暂开放后的阿尔茨海默病小鼠大脑中(如图4),并发现治疗后四天,与未治疗的对照脑相比,治疗的小鼠脑的Aβ斑块的数量,平均大小以及表面积显着降低了。最近,加拿大多伦多森尼布鲁克健康科学中心首次进行了利用UTMD技术打开BBB进行药物递送的临床试验,该试验基于以色列InSightec公司和GE公司共同设计的Exablate Neuro进行,在有高度恶性胶质母细胞瘤的患者中利用MRI引导使用聚焦超声来无创打开血脑屏障,递送阿霉素[9]。目前已经通过10位患者的临床研究证明了使用UTMD暂时打开BBB的可行性,安全性和有效性。利用MRI引导的UTMD系统通常利用MR测温法进行监控,温度精度为1°C,空间分辨率为1 mm,时间分辨率为1 s。

图 5 以色列InSightec公司和GE公司共同设计的Exablate Neuro
参考文献
[1] 周厚妊,张月,辛莹,李诗慧,刘小奇,刘治军.基于超声靶向微泡破坏技术的纳米给药系统的研究进展[J].临床超声医学杂志,2020,22(03):208-211.
[2] 邹朋林,陈惠莉,郑林丰,张焱锋,史秋生.超声靶向微泡破坏与载药/载基因纳米粒联合应用的生物物理学机制及应用研究进展[J].现代生物医学进展,2019,19(04):789-793.
[3] Li F, Jin L, Wang H, et al. The dual effect of ultrasound-targeted microbubble destruction in mediating recombinant adeno-associated virus delivery in renal cell carcinoma: transfection enhancement and tumor inhibition[J]. Journal of Gene Medicine, 2014, 16 (1-2) :28-39
[4] Bekeredjian R, Grayburn PA, Shohet RV. Use of ultrasound contrast agents for gene or drug delivery in cardiovascular medicine. J Am Coll Cardiol 2005;45:329-35
[5] Lum AF, Borden MA, Dayton PA, et al. Ultrasound radiation force enables targeted deposition of model drug carriers loaded on microbubbles. J Control Release 2006;111:128-34
[6] Castle J , Feinstein S B . Ultrasound-Directed, Site-Specific Gene Delivery[J]. Methods in Molecular Biology, 2014, 1141:67-76.
[7] McDannold N, Arvantis CD, Vykhodtseva N, et al. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: safety and efficacy evaluation in rhesus macaques. Cancer Res. 2012;72:3652–3663.
[8] Jordão JF, Ayala-Grosso CA, Markham K, et al. Antibodies targeted to the brain with image-guided focused ultrasound reduces amyloid-beta plaque load in the TgCRND8 mouse model of Alzheimer’s disease. PLoS One. 2010;5:e10549.
[9] https://clinicaltrials.gov/ct2/show/NCT02343991



