定义
靶向药物递送,有时也被称为智能药物递送[1],是一种给药方式,可以增加身体某些部位的药物浓度。这种给药方式主要基于纳米医学,目的是利用纳米颗粒介导药物给药,以对抗传统药物给药的衰落。这些纳米颗粒能够装载药物并针对身体只有病变组织的特定部位递送药物,从而避免与健康组织的相互作用。靶向给药系统的目的是延长、定位、靶向并使药物与病变组织相互作用。传统的药物释放系统是通过生物膜吸收药物,而靶向释放系统以剂型释放药物。靶向释药系统的优点是减少了患者服用的剂量和频率,使药物的作用更加统一,减少了药物的副作用,减少了循环药物水平的波动。该系统的缺点是成本高,生产更加困难,并降低了调整剂量的能力。
靶向给药系统已经被开发以优化再生技术。该系统在较长时间内向体内的目标患病区域递送一定数量的治疗剂。这有助于维持体内所需的血浆和组织药物水平,从而防止药物对健康组织造成任何损害。药物传递系统是高度集成的,需要化学家、生物学家和工程师等不同学科的共同努力来优化这个系统。
背景
在传统的药物传递系统(如口服或血管内注射)中,药物通过血液循环分布在全身。对于大多数治疗药物来说,只有小部分药物能到达受影响的器官,例如在化疗中,大约99%的药物不能到达肿瘤部位[2]。靶向给药旨在将药物集中在感兴趣的组织中,同时降低药物在其余组织中的相对浓度。例如,通过避开宿主的防御机制,抑制肝脏和脾脏的非特异性分布[3],药物可以以更高的浓度达到预期的作用位点。靶向给药被认为可以提高疗效同时减少副作用。
在实施靶向释放系统时,必须考虑以下设计标准:药物性质、药物的副作用、药物的释放路线、靶向部位和疾病。
靶向给药有两种:主动给药,如某些抗体药物;被动给药,如通透性增强和保留效应(enhanced permeability and retention effect, EPR-effect)[4]。
主动靶向Active Targeting
载药纳米颗粒的主动靶向增强了被动靶向的效果,使纳米颗粒更专一于一个靶点。有几种方法可以实现主动定位。一种单独针对患病组织的有效方法是了解药物靶向细胞上受体的性质[5]。然后,研究人员可以利用细胞特异性配体,使纳米颗粒特异性地结合到具有互补受体的细胞上。当使用转铁蛋白作为细胞特异性配体时,这种形式的主动靶向被发现是成功的[5]。转铁蛋白与纳米颗粒结合以靶向具有转铁蛋白受体介导的细胞膜内吞机制的肿瘤细胞。与非偶联纳米颗粒相比,这种靶向手段被发现可以增加吸收量。
利用磁性脂质体也可以实现主动靶向,磁性脂质体通常作为磁共振成像的造影剂。因此,通过磁定位可以将这些脂质体与所需的药物聚集到身体的某个部位。
此外,纳米颗粒能够被特定于目标部位的触发器激活,例如利用对pH值有反应的材料[5]。大多数身体有一个一致的PH,然而,身体的一些特定部位或疾病组织会具有更小的PH,因此,纳米颗粒可以利用这种能力在特定PH值的组织释放药物。另一个特定的触发机制是基于氧化还原电势。肿瘤的副作用之一是缺氧,这改变了肿瘤附近的氧化还原电位。通过改变触发有效载荷释放的氧化还原电位,小泡可以选择性地治疗不同类型的肿瘤[6]。
通过利用被动和主动靶向,载药纳米颗粒比传统药物具有更高的优势。它能够在体内循环很长一段时间,直到通过使用细胞特异性配体、磁定位或pH响应材料成功地吸引到目标物。由于这些优点,由于载药的纳米颗粒只影响患病组织,传统药物的副作用将大大减少[7]。然而,纳米毒理学这一新兴领域担心纳米颗粒本身可能对环境和人类健康造成威胁,并产生副作用[8]。
运载工具
载药载体有聚合物胶束、脂质体、脂蛋白载药载体、纳米载药载体、树状大分子等。理想的给药载体必须是无毒、生物相容性、非免疫原性、生物可降解的[9],并且必须避免被宿主的防御机制[2]识别。
1、脂质体Liposomes
目前用于靶向给药的最常见的载体是脂质体[10]。脂质体即使反复注射也无毒、无溶血、无免疫原性;它们具有生物相容性和生物可降解性,可设计以避免清除机制(网状内皮系统(RES)、肾脏清除、化学或酶失活等) [11]。脂基配体涂层纳米载体可以将有效载荷存储在疏水性外壳或亲水性内部,这取决于所携带的药物或对比剂的性质。
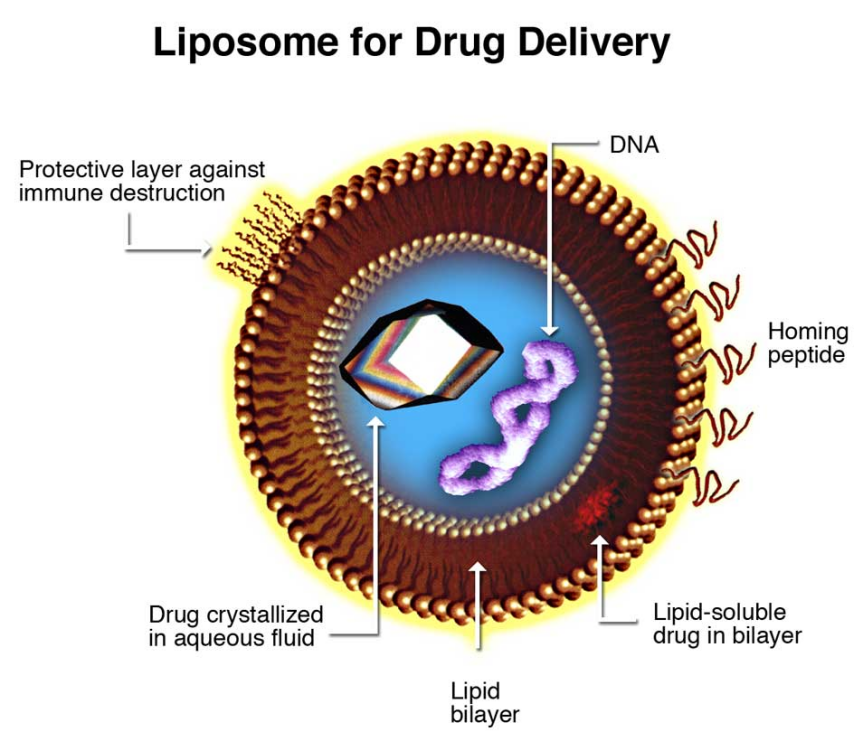
在体内使用脂质体的唯一问题是脂质体容易被RES系统摄取和清除,以及在体外的稳定性相对较低。为了解决这个问题,可以将聚乙二醇(PEG)修饰到脂质体表面。将脂质体表面PEG的摩尔百分比增加4-10%,可显著增加体内循环时间,从200分钟增加到1000分钟[2]。
脂质体纳米载体的聚乙二醇化延长了该结构的半衰期,同时保持了常赋予脂质体纳米载体的被动靶向机制[12]。当用作递送系统时,脂质体诱导结构不稳定的能力常被利用,使包裹的治疗剂在接近体内目标组织或细胞的地方选择性释放。这种纳米载体系统通常用于抗癌治疗,因为过度依赖糖酵解导致的肿瘤肿块酸性环境会触发药物释放。
2、胶束和树枝状分子
另一种药物载体是聚合物胶束。它们是由某些由亲水性和疏水性单体单元组成的两亲性共聚物制备的。它们可以用来携带溶解度差的药物。已经开发了利用活性聚合物和疏水性添加剂来生产具有不同尺寸的胶束的技术[13]。
树状大分子也是基于聚合物的运载工具。它们有一个核心,以规则的间隔分叉,形成一个小的、球形的、非常密集的纳米载体[14]。
3、可生物降解的粒子
可生物降解颗粒能够靶向病变组织,并将其有效载荷作为一种可控释放疗法。研究发现[15]生物降解颗粒与p -选择素、内皮选择素(e -选择素)和ICAM-1配体结合可粘附炎症内皮。因此,可生物降解颗粒也可用于心脏组织。
4、人造DNA纳米结构
DNA纳米技术成功地从DNA等核酸中构建了人工设计的纳米结构,并结合DNA计算系统的演示,这引发了人们的猜测:人工核酸纳米设备可用于基于直接感知其环境的靶向给药。这些方法只利用DNA作为一种结构材料和化学物质,而不利用其作为遗传信息载体的生物学作用。核酸逻辑电路可能被用作一个系统的核心,该系统释放药物只响应一个刺激,如一个特定的mRNA已经被证明。此外,利用DNA“折纸法”合成了一个带有可控盖的DNA“盒子”。这种结构能将药物封装在封闭状态,只有在需要刺激时才能打开释放。
参考文献
[1] Muller, R; Keck, C (2004). "Challenges and solutions for the delivery of biotech drugs – a review of drug nanocrystal technology and lipid nanoparticles". Journal of Biotechnology. 113 (1–3): 151–170.
[2] Trafton, A. Tumors Targeted Using Tiny Gold Particles. MIT Tech Talk. 2009, 53, 4–4.
[3] Bertrand N, Leroux JC.; Leroux (2011). "The journey of a drug carrier in the body: an anatomo-physiological perspective". Journal of Controlled Release. 161 (2): 152–63
[4] https://en.wikipedia.org/wiki/Targeted_drug_delivery
[5] Galvin, P.; Thompson, D.; Ryan, K. B.; Mccarthy, A.; Moore, A. C.; Burke, C. S.; Dyson, M.; Maccraith, B. D.; Gun’Ko, Y. K.; Byrne, M. T.; Volkov, Y.; Keely, C.; Keehan, E.; Howe, M.; Duffy, C.; Macloughlin, R. Nanoparticle-Based Drug Delivery: Case Studies for Cancer and Cardiovascular Applications. Cell. Mol. Life Sci. [Online] 2011, 69, 389–404.
[6] Noyhouzer, Tomer; L’Homme, Chloé; Beaulieu, Isabelle; Mazurkiewicz, Stephanie; Kuss, Sabine; Kraatz, Heinz-Bernhard; Canesi, Sylvain; Mauzeroll, Janine (2016-05-03). "Ferrocene-Modified Phospholipid: An Innovative Precursor for Redox-Triggered Drug Delivery Vesicles Selective to Cancer Cells". Langmuir. 32 (17): 4169–4178.
[7] Mitra, A. K.; Kwatra, D.; Vadlapudi, A. D. Drug Delivery; Jones & Bartlett Learning: Burlington, Massachusetts, 2015.
[8] Jong, W. H. D.; Borm, P. J. A. Drug Delivery and Nanoparticles: Applications and Hazards. Int. J. Nanomedicine. [Online] 2008, 3, 133–149. The National Center for Biotechnology Information.
[9] Scott, Robert C; Crabbe, Deborah; Krynska, Barbara; Ansari, Ramin; Kiani, Mohammad F (2008). "Aiming for the heart: targeted delivery of drugs to diseased cardiac tissue". Expert Opinion on Drug Delivery. 5 (4): 459–70.
[10] Cobleigh, M; Langmuir, VK; Sledge, GW; Miller, KD; Haney, L; Novotny, WF; Reimann, JD; Vassel, A (2003). "A phase I/II dose-escalation trial of bevacizumab in previously treated metastatic breast cancer". Seminars in Oncology. 30 (5 Suppl 16): 117–24.
[11] Seidman, A.; Hudis, C; Pierri, MK; Shak, S; Paton, V; Ashby, M; Murphy, M; Stewart, SJ; Keefe, D (2002). "Cardiac Dysfunction in the Trastuzumab Clinical Trials Experience". Journal of Clinical Oncology. 20 (5): 1215–21.
[12] Lee, Jinhyun Hannah; Yeo, Yoon (2015-03-24). "Controlled drug release from pharmaceutical nanocarriers". Chemical Engineering Science. Pharmaceutical Particles and Processing. 125: 75–84.
[13] Macosko, Cristopher W. "Polymer Nanoparticles Improve Delivery of Compounds” University of Minnesota Office for Technology Commercialization."Nanodelivery". Archived from the original on 2012-03-24.
[14] Pili, R.; Rosenthal, M. A.; Mainwaring, P. N.; Van Hazel, G.; Srinivas, S.; Dreicer, R.; Goel, S.; Leach, J.; et al. (2010). "Phase II Study on the Addition of ASA404 (Vadimezan; 5,6-Dimethylxanthenone-4-Acetic Acid) to Docetaxel in CRMPC". Clinical Cancer Research. 16 (10): 2906–14.
[15] Homsi, J.; Simon, G. R.; Garrett, C. R.; Springett, G.; De Conti, R.; Chiappori, A. A.; Munster, P. N.; Burton, M. K.; et al. (2007). "Phase I Trial of Poly-L-Glutamate Camptothecin (CT-2106) Administered Weekly in Patients with Advanced Solid Malignancies". Clinical Cancer Research. 13 (19): 5855–61.



