背景
1994年,受激发射消耗显微成像技术(STED)的原理被德国科学家Stefan W.Hell提出[1],并于2000年实现真正的成像过程[2]。2014年的诺贝尔化学奖被授予德国马克斯·普朗克生化研究所教授Stefan W.Hell,美国霍华德休斯医学研究所教授Eric Betzig和美国斯坦福大学教授William Moerner,以用于表彰其对超分辨荧光显微成像领域作出的卓越贡献。
工作原理
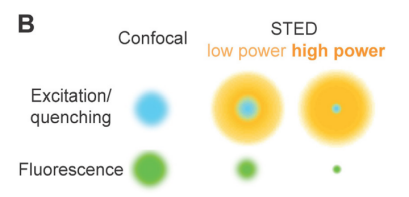
受激发射消耗显微成像技术(STED)通过对点扩散函数(PSF)的调制,实现超过光学衍射极限分辨率的超分辨成像。STED技术基于共聚焦显微成像技术,除了激发光所在光路以外,还引入新的一路与激发光共轴的光束,称为损耗光光束。损耗光经过相位板之后,可形成围绕激发光的光环,呈现甜甜圈型。通过激发光的照射,使得生物样本的荧光分子跃迁至激发态。并且由于环形同轴损耗光光束的照射,当两光束重叠区域的处于激发态的荧光分子遇到损耗光光子,并且这个损耗光光子的波长满足受激辐射条件时,这个区域的荧光分子进入不发光的损耗态。仅在焦点处最中间的小区域,由于未受到或受到极弱损耗光的影响,该位置的荧光分子将处于激发态并激发出荧光信号,有效降低点扩散函数的宽度,从而实现超分辨成像[3-6]。图1 为STED激发PSF原理图。
|
图 1 STED激发PSF原理图[3] |
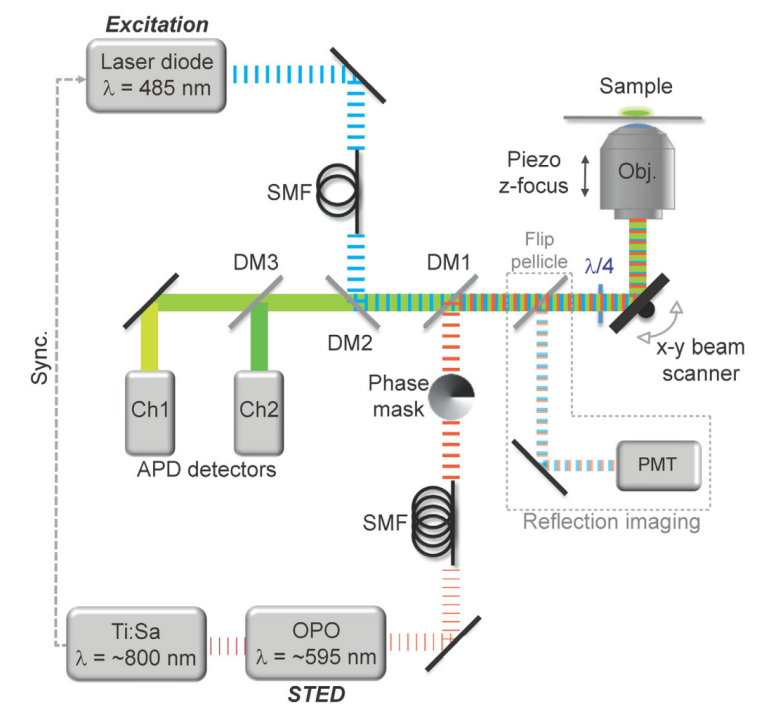
图 2 STED显微镜结构原理图[3] |
STED显微镜的分辨率主要是由有效荧光光斑的大小及损耗效果决定的。可以通过各种措施改善STED光在焦平面相干形成的抑制光圈的干涉对比度及中心强度分布,通过改善影响相干的条件,压缩荧光光斑的大小,尽可能提高横向和轴向抑制比。影响相干抑制的因素有STED光的光强、偏振态和脉宽,激发光的强度和脉宽、相位板以及系统像差和脉冲延迟,可通过相关的措施改善抑制效果,提高系统的分辨率。
受激发射损耗显微镜组成部分
一个典型的STED显微成像系统主要由以下几个部分组成:超连续激光器、共聚焦显微镜、纳米平移台、APD探测器、时间相关的单光子计数器(TCSPC)及分析软件。包括两路共轴激光,分别为激发光和损耗光,两束激光之间进行时序的同步。相位板用于损耗光生成环状光斑,扫描振镜用于x,y方向的扫描,APD雪崩二极管用于荧光信号的探测。
优缺点
横向分辨率为20-70nm,轴向分辨率为40-150nm,时间分辨率为毫秒量级。相比于其他超分辨显微成像技术,受激发射损耗显微成像的优缺点:
优点:成像无需后期的算法处理,成像速度快。
缺点:光路复杂,设备昂贵,对系统的稳定性要求很高[7]。
应用
从1994年至今,STED技术经过了近20年的发展,已经变得越来越完善,同时也在多个领域中得到了应用。STED最为基本的应用是对荧光样品的强度分布进行成像。目前,STED显微术已经成功实现了对于荧光纳米颗粒,荧光标记的生物细胞等样品进行强度成像。通过将STED成像效果和常规共焦显微术(Confocal)的成像效果进行对比可以发现,STED技术对于分辨率有一个明显的提升,更多的样品细节可以被STED显微术解析出来。除了对于静态样品进行观测之外,STED技术还可以应用于活体样品的成像之中实现超衍射极限的分辨率。
与其他超分辨技术相比,STED显微镜独特的三维层析能力使得其具有更深的成像深度,为其在活体成像应用中提供优势。图为STED显微镜用于肌动蛋白微丝的超分辨表征,并在62nm的分辨率下揭示了树突棘形态的动态变化[8]。
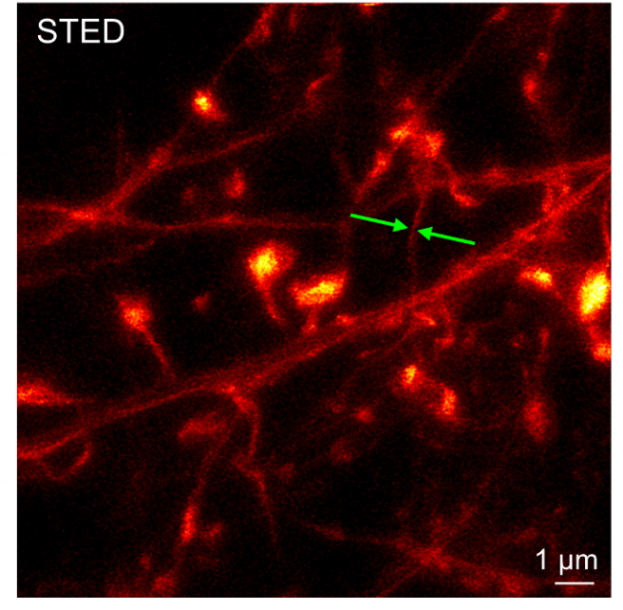
STED肌动蛋白成像结果[8]
STED技术还可用于对荧光样品进行荧光寿命测量(FLIM)及荧光相关谱测量(FCS),从而使得STED系统成为了一种多功能超分辨成像系统,在生物医学等领域中的应用也变得更加广泛。除了在成像领域的应用之外,STED超分辨的思想在微细结构的光刻,超高密度的存储等领域也有广泛的应用,为材料学等领域的发展也做出了重要的推进作用[9-11]。
参考文献
[1] S, W, Hell, et al. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy.[J]. Optics letters, 1994.
[2] Klar, Thomas, A, et al. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000.
[3] Chéreau, Ronan, Tonnesen J , NaGerl U V . STED microscopy for nanoscale imaging in living brain slices[J]. Methods, 2015:S1046202315002479.
[4] Wijetunge L S , Angibaud J , Frick A , et al. Stimulated Emission Depletion (STED) Microscopy Reveals Nanoscale Defects in the Developmental Trajectory of Dendritic Spine Morphogenesis in a Mouse Model of Fragile X Syndrome[J]. Journal of Neuroscience, 2014, 34(18):6405-6412.
[5] Willig K I , Rizzoli S O , Westphal V , et al. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis.[J]. Nature, 2006, 440(7086):P.935-939.
[6] 付芸,王天乐,赵森.超分辨光学显微的成像原理及应用进展[J].激光与光电子学进展,2019,56(24):21-33.
[7] 吕志坚,陆敬泽,吴雅琼,陈良怡.几种超分辨率荧光显微技术的原理和近期进展[J].生物化学与生物物理进展,2009,36(12):1626-1634.
[8] Veer M J T T , Pfeiffer T , U. Valentin Nägerl. Two-Photon STED Microscopy for Nanoscale Imaging of Neural Morphology In Vivo[J]. methods in molecular biology.
[9] 李帅,匡翠方,丁志华,郝翔,顾兆泰,葛剑虹,刘旭.受激发射损耗显微术(STED)的机理及进展研究[J].激光生物学报,2013,22(02):103-113.
[10] 陈文霞,肖繁荣,刘力,王桂英.利用受激发射损耗(STED)显微术突破远场衍射极限[J].激光与光电子学进展,2005(10):51-56.
[11] https://baike.baidu.com/item/受激发射损耗荧光显微术/16694584