定义
遗传光学(Optogenetics)是一种将遗传工程与光学技术相结合,用于精确控制生物组织内神经元活动的方法。其中遗传工程(Genetic engineering)指人为改变生物组织中基因编码(Genetic code)内容的过程。
背景
大脑是如何工作的?这是几个世纪以来科学家渴望解决的问题。
神经元通过电信号和化学反应进行神经元间的信息交流。早在十八世纪,意大利科学家Luigi Galvani曾在一个雷雨天经过一个市场,他发现商贩贩卖的蛙腿在摆动,便假设暴雨产生的电信号刺激了蛙腿摆动,随后对此假设进行验证。Galvani使用电极对蛙腿进行通电,并观察到蛙腿摆动现象。这是神经科学领域第一个电流刺激实验[1]。通过这个实验,Galvani得出神经元可以通过传输电信号进行信息交流这个结论。二十世纪三十年代,脑外科医生Wilder Penfield从事治疗癫痫病人的活动。癫痫病人脑部会产生异常电信号,在一些特殊病例中,需要手术消除这些异常电信号。因此Penfield医生希望建立大脑结构图(Map),寻找人脑中最重要的部分。Penfield医生通过使用低电压信号刺激人脑不同区域同时观察病人肢体反应,发现特定区域的大脑对应特定区域的肢体,经过整理,建立了第一个人脑区域对应运动区域的功能图[2],称为Homunculus。但是使用电信号刺激人脑有如下缺点:(1)电极的插入可能会损害人脑。(2)电信号刺激人脑准确性较差,无法精确刺激某一片或某一种神经元。为了避免这两个缺陷,使用光遗传技术研究人脑,使用光对特定神经元进行刺激或者抑制,如图 1所示为电刺激和光刺激(抑制)神经元对比图。在2005年,科学家提出了光遗传技术。随后,光遗传技术被广泛应用于大脑和神经系统研究中。
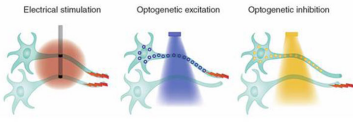
图 1 神经元刺激抑制示意图
光遗传工作原理
神经元(Neurons)是大脑和神经系统中一类特殊的细胞,不同神经元间的协同工作产生生物组织的思想与行为。为了研究大脑的工作原理,需要研究神经元的工作原理。人的大脑非常复杂,但是很多动物大脑的某些特性与人类相似,因此可以通过研究不同动物大脑工作原理进而研究人类大脑工作原理。
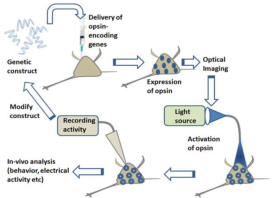
图 2 光遗传原理示意图
如图2所示为光遗传原理示意图。在遗传光学研究过程中,科学家找到神经元对应的基因编码,并人工加入一段编码。这段新加入的基因编码,使得神经元产生特殊的蛋白质。这种蛋白质对光有响应,叫做视蛋白(Opsins)。视蛋白最早在海藻中发现,用于调节自身姿态以适应不同光照条件。但是如何将视蛋白引入到神经元中,以老鼠为例,需要找到老鼠神经元的基因编码(Genetic Code),并将视蛋白的基因编码插入到其中,如果操作过程恰当,那么在基因表达时,老鼠体内的神经元就会含有视蛋白。当深入了解老鼠的基因编码后,可以选择特定种类、特定位置的神经元基因编码插入视蛋白基因编码,这样可以选择所需的神经元进行控制。在神经科学中,最常见的视蛋白是来源于衣藻的光敏感通道蛋白(channelrhodopsin-2,ChR2)[3],其对蓝光敏感,即当且仅当蓝光波段激励光照射时光敏感通道蛋白处于激活状态[4]。即将光敏感通道蛋白插入到神经元中后,当有蓝光照射时,神经元就会处于激活状态。这样可以在特定时间通过蓝光刺激特定位置的神经元。通过研究神经元受到光刺激后的神经信号传输情况,可以更好的研究大脑的工作原理。
如同城市中有很多道路一样,大脑中也存在很多通路。一片区域的所有道路总和,称为这片区域的道路图(Structural Map),显示道路如何建立;当从A点到达B点时可以有很多种不同的道路,把实际通过的道路称为功能图(Functional Map),显示道路如何被利用。
在大脑中,神经元如同道路,神经元中传输的神经信号如同汽车。通常情况下,大脑处于活跃状态,所以有很多神经信号同时在不同的神经元上传输,无法看出神经信号沿神经元传输的关联性。为了更好的研究大脑工作原理,需要控制神经元传输信号的起始时间和起始地点。在使用电刺激神经元传输信号时,虽然可以控制起始时间,但是电刺激位置附近所有神经元都会受到影响产生神经信号,无法精确控制某一神经元工作。使用光遗传技术可以在所需时刻,准确控制某一种或某一片区域的神经元发出神经信号,时间分辨率可达毫秒级,空间分辨率为单个神经元,这样可以帮助科研人员更深入地了解神经元传输神经信号的原理。
在看地图时,可以通过缩小比例看城市间的主干道,也可以通过放大比例看某一街区的小道路,与此相似,在观看大脑工作时,首先可以缩小比例观察不同大片区域间的信号连接,以研究远距离神经信号传输和脑区域间的联系,例如,应用光遗传技术刺激某一片大脑区域,同时记录其他脑区域的响应,找到传输信号最多的脑区域,这有助于理解各种生物行为产生的原理,还有助于理解当某一区域的大脑受损时,会相应产生何样的影响。其次,还可以放大比例观察神经元个体之间的神经信号传输,利用光遗传技术,研究神经元之间的联系,使用激励光刺激某些特定的神经元,并观察相应的神经元响应,这有助于研究神经元之间的交流方法。随着光遗传技术的发展和更多视蛋白的发现与利用,可以深入的研究大脑的工作原理。
光控蛋白
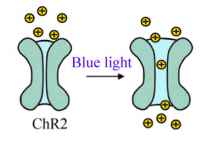
图 3 光控蛋白ChR2工作原理示意图
如图3所示,为较常用的ChR2光控蛋白的工作原理,当有蓝光照射时,光控蛋白离子通道打开,允许离子通过,当与神经元协同工作时,起到刺激神经元的作用。
光控蛋白包括视蛋白和光敏蛋白(Photonsensitive Protein)。除了视蛋白,光敏蛋白同样可应用于光遗传技术中,根据不同需求,光控蛋白可应用于不同光遗传技术应用环境中。
视蛋白是一种光敏跨膜蛋白,广泛存在于各种生物中,可以分为Ⅰ型微生物类或Ⅱ脊椎/非脊椎动物类。光敏蛋白属于非视蛋白依赖光遗传学元件,其通过吸收激励光光子能量,完成构象变化或者促进蛋白之间的相互作用与重排。光敏蛋白具有如下特点:(1)易于被基因编码和表达。(2)光响应具有较大动态变化范围,且背景噪声较低。(3)对细胞内源性蛋白功能和亚细胞定位造成的影响小。(4)激活光波长具有特异性和快速响应性。根据不同工作原理,光敏蛋白分为以下几种:(1)光控二聚化系统:光敏色素、隐花色素、紫外响应受体、变构蛋白(2)寡聚系统。
发展及应用
2005年,科学家首次提出光遗传技术[3]。
2013年,光遗传技术被用来从不同角度研究大脑,包括大片脑区域之间的联系或者神经元之间的联系[5]。
2014年,光遗传技术被用来研究恐惧心理、风险与利益计算、记忆存储与脑部神经元活动间的联系[6]。
2015年,光遗传技术被用来研究小鼠脑部中风前后,大脑产生的变化[7]。
参考文献
[1] Kolb, B., Whishaw, I. Q., and Teskey, G. C. 2016. An Introduction to Brain and Behavior. 5th ed. New York, NY: Worth.
[2] Penfield, W., and Edwin, B. 1937. Somatic motor and sensory representation in the cerebral cortex of man as studied by electrical stimulation. Brain 60(4):389–443. doi:10.1093/brain/60.4.389
[3] Nagel, G., Szellas, T., Huhn, W., Kateriya, S., Adeishvili, N., Berthold, P., et al. 2003. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc. Natl. Acad. Sci. U.S.A. 100:13940–5. doi:10.1073/pnas.1936192100
[4] Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., and Deisseroth, K. 2005. Millisecond-timescale genetically targeted optical control of neural activity. Nat. Neurosci. 8:1263–8. doi:10.1038/nn1525
[5] Lim, D. H., LeDue, J., Mohajerani, M. H., Vanni, M. P., and Murphy, T. H. 2013. Optogenetic approaches for functional mouse brain mapping. Front. Neurosci. 7:54. doi:10.3389/fnins.2013.00054
[6] Deisseroth, K. 2015. Optogenetics: 10 years of microbial opsins in neuroscience. Nat. Neurosci. 18(9):1213–25. doi:10.1038/nn.4091
[7] Lim, D. H., LeDue, J., Mohajerani, M. H., and Murphy, T. H. 2014. Optogenetic mapping after stroke reveals network-wide scaling of functional connections and heterogeneous recovery of the peri-infarct. J. Neurosci. 34(49):16455–66. doi:10.1523/JNEUROSCI.3384-14.2014



