在几何光学中,一个理想光学成像系统使点物成点像。但实际上由于任何光学系统都有限制光束的光瞳,它带来的衍射效应是无法消除的,所以光学系统所成的点物的像应该是一个衍射像斑。自然,这个像斑非常接近于点像,因为通常光学系统的光瞳都比光波波长大得多,从而衍射效应极小。光学成像系统的成像分辨率指的是它能分辨开两个靠近的点物或物体细节的能力。光学系统对点物所成的“像”是一个夫琅和费衍射图样。这样,对于两个非常靠近的点物,它们的“像”(衍射图样)就有可能分辨不开,因而也无从分辨两个点物。即存在可区分的最小的物方分辨距离。
光学衍射极限
根据瑞利判据,光学显微镜的光学分辨率受限于光学衍射极限。其最小分辨率可定义为用显微镜可以区分开来的两个同等亮度的点光源之间的最小距离。无论是宽场显微镜还是共聚焦显微镜,单个点光源经过透镜组和物镜汇聚后都会在焦平面上产生一个模糊的光斑(airy disc)。根据瑞利判据,光学显微成像系统的光学衍射极限分辨率可表示为:
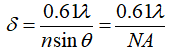
其中,λ是入射光的波长,n是介质的折射系数,θ 是物镜的半孔径角度,而NA则是物 镜 的数值孔径。假设光源的波长λ为400nm,物镜和样本之间的介质为空气(折射率n=1),此时的分辨率为200nm[1]。为了提高光学显微镜的分辨率,早期的工作往往集中在如何减小艾里斑的尺寸,包括减小光的波长、增大数值孔径。对于前者,直接导致了各种电子显微镜的诞生。采用波长为纳米甚至亚纳米级的电子束进行成像,其分辨率可达纳米量级甚至更小。对于后者,一方面可以更高折射率的成像介质,如在显微成像中把样本浸水以增加折射率。另一方面,可以利用结构更为复杂的光学收集系统(如共轭双物镜)来增加光学显微镜的有效孔径角,从而提高光学显微镜相对较差的轴向分辨率,其典型代表为4Pi显微镜。此外,还可以使用共焦小孔等来限制艾里斑的尺寸并消除杂散光,从而提高光学显微镜的横向和纵向分辨率,其典型代表是共聚焦显微镜(Confocal Microscope)。值得指出的是,这里所述的光学显微镜指的是远场光学显微镜(Far-field Optical Microscope),物镜和样本之间的距离远大于光的波长。进一步的研究表明,远场光学显微镜存在分辨率极限的主要原因在于远场一般只能收集传导波信号,而携带了高频信息的倏逝波(Evanescent Wave),其电场强度随传播距离的增加而呈指数衰减。因此,若使用距样本表面仅几个纳米的探针收集并探测近场光信号,可以大幅提高光学显微镜的分辨率,这种思路导致了近场扫描光学显微镜(Near-field Scanning Optical Microscope, NSOM)的诞生,其分辨率可以优于25 nm。而基于倏逝场扫描成像的光学显微镜,通常被称为近场光学显微镜(Near-field Optical Microscope)[2]。
超分辨成像
光学显微镜凭借其非接触、无损伤等优点,长期以来是生物医学研究的重要工具。普通的光学显微成像技术分辨率对于平均直径为10-20um的人体细胞已经足够。电子显微镜可以达到纳米量级的分辨率,能够观察到细胞内部囊泡、线粒体等细胞器的定位,但是由于缺乏特异性的探针标记,不适合定位单个蛋白质分子,也不适合观察活细胞和细胞膜的动态变化过程。因此,生物学家迫切希望有 一种实验显微方法,它既具有亚微米甚至纳米尺度的光学分辨本领,又可以连续监测生物大分子和细胞器微小结构的演化,而并不影响生物体系的生物活性。超分辨光学显微镜(Super-resolution Optical Microscopy)应运而生。无超分辨光学成像,打破了光学显微镜的分辨率极限(换言之,超越了光学显微镜的分辨率极限,故被称为超分辨光学成像),将分辨率从几百纳米提高到几十纳米。为生命科学研究提供了前所未有的工具。
超分辨光学显微的成像原理主要分为两类:一类是基于单分子定位显微成像,它包括光激活 定位显微(PALM)和随机光学重构显微(STORM); 另一类是基于点扩展函数(PSF)调制的超分辨显微成像,它包括受激发射损耗显微(STED)和结构光照明显微(SIM)[3-7]。在对应的详细词条中,都会有更详细的介绍。超分辨显微成像技术在发现细胞内新结构、生物分子相互作用,定量分子计数,和动态时间跟踪方面具有重要应用。
发展趋势
超高分辨率显微成像技术的发展趋势应该是满足生物、材料和医学成像中三维、活体和快速成像的需求,即获得更高的空间和更快的时间分辨率以满足更小尺度更快生物过程的研究,以及需要得到更深的成像深度以满组织和个体的成像需求。应当从以下几个方面入手改进:
1、发展新的超分辨硬件技术:例如更高输出功率的激光器、更低光损耗的透镜光学组件、更稳定的光学系统、更快的扫描元件、更高数值孔径且工作距离更长的显微镜物镜、更快更灵敏的单光子探测器、更智能的自适应光学系统等。
2、开发和优化新的探针及其标记方法:对荧光蛋白和染料做结构分析、改造,提高荧光蛋白和有机染料的亮度、光稳定性、光激活、光转化、光开关特性以及转换速率等特性;开发新型的有机、无机探针,如金颗粒、半导体量子点、聚合物量子点、上转换纳米颗粒等;提高探针的标记特异性、降低非特异性结合也是提高分辨率的努力方向。
3、发展多模态融合:将基于荧光的超高分辨率成像技术与基于粒子的电子显微镜结合,发挥二者各自互补的优势,实现电子显微镜和光学显微镜各自的优势,即超高分辨率和分子特异性的完美结合即“光电联合显微技术”(correlative light & electron microscopy,CLEM)。
4、开发新的数据处理算法:面对三维大尺度(例如整个神经元,整个脑组织)的成像,以及4D基因组成像的需求,我们将面临TB级别数据的处理,大数据时代需要更加高效的图像处理算法和软件,此外,对于超分辨数据深度挖掘也是未来发展的方向之一。
参考文献
[1] 郁道银,谈恒英.工程光学[M].第四版,机械工业出版社,2015.11
[2] https://baike.baidu.com/item/超分辨光学成像
[3] 付芸,王天乐,赵森.超分辨光学显微的成像原理及应用进展[J].激光与光电子学进展,2019,56(24):21-33.
[4] Willig K I , Rizzoli S O , Westphal V , et al. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis.[J]. Nature, 2006, 440(7086):P.935-939.
[5] Bates M , Jones S A , Zhuang X . Stochastic Optical Reconstruction Microscopy (STORM): A Method for Superresolution Fluorescence Imaging[J]. Cold Spring Harbor Protocols, 2013, 2013(6):498.
[6] Sydor A M , Czymmek K J , Puchner E M , et al. Super-Resolution Microscopy: From Single Molecules to Supramolecular Assemblies[J]. Trends in Cell Biology, 2015, 25(12):730-748.
[7] Manish Saxena, Gangadhar Eluru, and Sai Siva Gorthi, "Structured illumination microscopy," Adv. Opt. Photon. 7, 241-275 (2015)



