基本背景
荧光蛋白由于可以很好地实现荧光“开”、“关”控制,因而在基于单分子定位的超分辨成像方面具有重要的应用。被生物科学家广泛使用于光激活定位显微技术photoactivated localization microscopy(PALM)和随机光学重构显微技术stochastic optical reconstruction Microscopy (STORM)中,用于突破光学衍射极限成像[1-2]。
1962 年,Shimomura等从维多利亚多管水母中分离纯化生物发光蛋白质———水母蛋白。1974 年,Shimomura等纯化得到了这种自发荧光的蛋白(即 GFP)。1985年Prasher等构建维多利亚多管水母的cDNA文库,用于克隆水母蛋白的编码基因,并得到含有 GFP 片段的蛋白。1992年Prasher等克隆到编码全长GFP的cDNA。但直到此时人们对GFP的应用前景还不甚了解。1994年,Chalfie等首次在原核的大肠杆菌和真核的秀丽隐杆线虫中表达了具有荧光性的GFP,证明GFP的荧光产生不需要水母中特异组分的参与。同年,钱永健及其同事提出GFP中Ser65-Tyr66-Gly67氨基酸残基形成 4-对羟基苯甲基-5-咪唑啉酮生色团发光的机制,并表明生色团的形成不需要任何酶或辅助因子的参与,而只需分子氧的存在。此后对GFP的研究进入了高潮,并在 1996 年解析了其晶体结构。基于已有知识和晶体结构,人们通过突变的方法得到许多不同荧光性质的GFP。荧光蛋白的使用范围不断扩大,极大地促进了生命科学和医药科学的发展。2008年,诺贝尔化学奖授予 Osamu Shimomura,Martin Chalfie和 Roger Tsien(钱永健),以表彰他们因“发现和发展了绿色荧光蛋白”所做的巨大贡献。
绿色荧光蛋白GFP结构
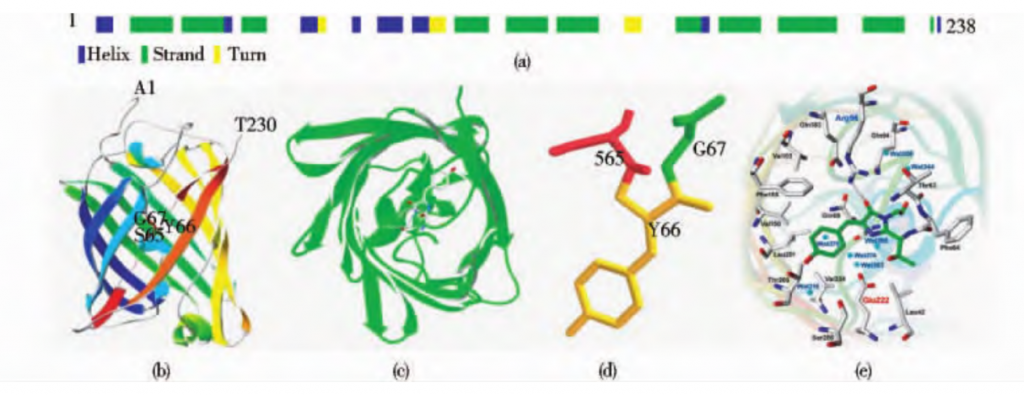
从维多利亚多管水母中分离出来的野生型GFP(avGFP)由238个氨基酸残基组 成,分子质量约27kDa,二级结构包括11个β折叠链(β-sheet strand),8个螺旋,3个转折[图 1(a)],三维结构为高×直径为42×24的β圆柱,圆柱两端由一些较短的α螺旋盖住,圆柱中央是几段α 螺旋,生色团的三肽位于圆柱中央[图1(b)-(d)]。该结构性质稳定,圆柱内部的微环境对维持生色团的正确构象从而产生荧光以及保护生色团不被氧气淬灭等都有重要作用[3]。
不同类型
通过定点突变和随机突变得到了不同突变型avGFP样蛋白,珊瑚类荧光蛋白的发现使人们发展出更多性质各异的荧光蛋白,发射谱覆盖420-655nm,应用范围不断扩大。
1、蓝色荧光蛋白
蓝色荧光蛋白( blue fluorescent protein,BFP)激发峰约381nm(统计一些常见荧光蛋白的平均值,下同)发射峰约445 nm。其激发光接近于紫外光,在操作中易对细胞产生伤害,且较短的发射光波长还易导致细胞的自荧光现象。
2、绿色荧光蛋白
绿色荧光蛋白是最早发现并得以应用的荧光蛋白,激发峰约486nm,发射峰约 506nm。GF PS65T突变体荧光强度比野生型GFP 强5倍,进一步进行 F64L 突变得到 37℃ 下高效成熟的EGFP,是目前应用最广泛的荧光蛋白之一,其不足在于对 pH 稍敏感,有较弱的二聚体倾向。
3、黄色荧光蛋白
黄色荧光蛋白( yellow fluorescent protein,YFP)激发峰约518nm,发射峰约 531nm。改造自avGFP的EYFP,是荧光最强、使用最广泛的荧光蛋白之一,但它对酸性十分敏感,pH6.5条件下其荧光强度丧失50% ,同时其对氯离子也十分敏感,与许多来自水母的荧光蛋白相比光稳定性也较差,但也可以利用此性质作为检测细胞内 pH 和氯离子浓度的生物传感器。许多来自于珊瑚的荧光蛋白本身就发射长波荧光(橙色、红色),很好地补充了荧光蛋白发射谱,拓宽了荧光蛋白的应用范围。
4、橙色荧光蛋白
橙色荧光蛋白( orange fluorescent protein,OFP) 激发峰约554nm,发射峰约578 nm。对DsRed定点突变和随机突变发展出许多有用的 DsRed 系列荧光蛋白。此外还有 mOrange、mOrange2等橙色荧光蛋白。
5、红色荧光蛋白
红色荧光蛋白( red fluorescent protein,RFP)是另一类广泛使用的荧光蛋白,激发峰约576nm,发射峰约607nm。在众多红色荧光蛋白中最值得注意的“mFruit”系列蛋白,mFruit由mRFP1发展而来,而mRFP1则改造自DsRed蛋白。目前应用最广泛的mFruit蛋白是mCherry和mStrawberry,其中mCherry的光稳定性更好因而更受青睐。
6、具有特殊光学性质的荧光蛋白
除以上常规荧光蛋白外,人们还发展了一系列有特殊光学性质的“光学荧光笔”(optical highlighters)。这类蛋白包括光活化荧光蛋白(photoactivatable FPs,PA-FPs)、光转化荧光蛋白( photoconvertable FPs,PC-FPs)和光开关荧光蛋白( photoswitchable FPs,PS-FPs)等。PA-FPs生色团成熟需特殊波长的光进行诱导( 可逆或不可逆);PC-FPs 能随激发光波长地改变发出不同颜色的荧光;PS-FPs可以根据特定波长光照的改变在荧光态和非荧光态之间转化。显然这一类荧光蛋白能更好地实现人工控制,目前这类蛋白荧光谱还较窄,且大部分荧光强度有限,限制了其应用,但其在超分辨成像(super-resolution imaging)上的应用十分值得关注。此外还有一类发射谱随时间变化的荧光蛋白,称为“荧光时钟”(fluorescent timers),可能在组织发育、蛋白成熟和转移等研究方面有潜在应用价值[5]。
GFP应用优点
GFP 的荧光性质比较特殊,具有诸多优点而备受关注。
(1)易于检测,灵敏度高
GFP荧光反应不需要外加底物和辅助因子,只需紫外光或蓝光激发,即可发出绿色荧光,用荧光显微镜甚至肉眼就可以观察到。其次,即便是未经纯化的GFP发射的绿光也是相当强的,在正常室内光线下仍清晰可辨。对于单细胞水平的表达也可识别。
(2)荧光性质稳定
GFP对光漂白(一种荧光衰减现象)有较强的耐受性,能耐受长时间的光照,从而延长了可探测时间;GFP 在 pH7-12范围内也能正常发光,对高温(70℃)、碱性、除垢剂、盐、有机溶剂和大多数普通酶都有较强抗性。
(3)对细胞无毒害
从目前的研究结果来看,GFP对生活的细胞基本无毒害,与目的基因融合后,对目的基因的结构功能没有影响,转化后细胞仍可连续传代。
(4)构建载体方便
由于编码GFP的基因序列很短,所以很方便地同其它序列一起构建多种质粒,而不至于使质粒过大影响转化频率。
(5)可直接用于活细胞测定
GFP 是能在异源细胞内表达后,能自发产生荧光的蛋白,并且GFP的分子量较小,N-端和 C-端都能忍受蛋白的融合,是理想的标记物,可进行活细胞实时定位观察,更能接近自然真实的状态。如在活细胞中直接观察蛋白向细胞核、内质网运动的状态,还可实时观察到外界信号刺激下,目的蛋白的变化过程,借助荧光显微镜观察,使研究更为方便。使用激光共聚焦显微镜 ,其图像效果更佳,结合现代的计算机软件,可进行三维显示 。
(6)不受假阳性干扰
由于其他生物本身不含有GFP,因此不会出现假阳性结果,GFP 作为分子探针可以代替荧光染料,避免由于染料扩散造成的定位不准 ,使结果真实可靠。
(7)广谱性
表现在GFP 的表达几乎不受种属范围的限制,在微生物、植物、动物中都获得了成功的表达,其次是GFP没有细胞种类和位置上的限制,在各个部位都可以表达发出荧光。
(8)易于得到突变体
如GFP中氨基酸的替换可产生不同光谱特性的突变体,且增强了荧光强度,适合在不同物种中专性表达[5-7]。
参考文献
[1] Hess S T , Girirajan T P K , Mason M D . Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy[J]. Biophysical Journal, 2006, 91(11):4258-4272.
[2] Bates M , Jones S A , Zhuang X .Stochastic Optical Reconstruction Microscopy (STORM): A Method for Superresolution Fluorescence Imaging[J]. Cold Spring Harbor Protocols, 2013, 2013(6):498.
[3] 邓超, 黄大昉, 宋福平. 绿色荧光蛋白及其应用[J]. 中国生物工程杂志, 2011, 31(1).
[4] Craggs, Timothy D . Green fluorescent protein: structure, folding and chromophore maturation[J]. Chemical Society Reviews, 2009, 38(10):2865.
[5] 吴沛桥,巴晓革,胡海,赵静.绿色荧光蛋白GFP的研究进展及应用[J].生物医学工程研究,2009,28(01):83-86
[6] Day R N,Davidson M W. The fluorescent protein palette: tools for cellular imaging. Chem Soc Rev,2009,38(10): 2887-2921
[7] Piatkevich K D,Verkhusha V V.Advances in engineering of fluorescent proteins and photo-activatable proteins with red emission.Curr Opin Chem Biol,2010 14(1):23-29.



